
医学院 新闻动态
2025年7月4日,西湖大学医学院、清华大学免疫学研究所胡小玉课题组在Science Immunology杂志在线发表题为“Tuft cells restrain intestinal type 2 immunity through the transcription factor Spi-B”的封面文章。该研究报道了肠道簇细胞(tuft cell)中内源性转录因子Spi-B主动抑制过度2型免疫激活及维持肠道免疫稳态的关键重要作用,并强调了簇细胞在2型免疫反应中兼具促进与抑制的双重调节功能。
原文链接:
https://www.science.org/doi/10.1126/sciimmunol.ads5818

2型免疫反应是机体抵御寄生虫感染的重要防御机制,但其异常激活与多种过敏性疾病(如哮喘、食物过敏等)的发生密切相关。这一复杂的免疫反应由上皮细胞释放的多种警报素(包括TSLP、IL-25、IL-33)启动,激活ILC2、Th2细胞及嗜酸性粒细胞等免疫细胞,诱导IL-4、IL-5、IL-13等关键2型细胞因子的产生,从而形成典型的2型免疫炎症级联反应。胡小玉课题组此前在2型免疫调控机制研究方面已取得重要进展,阐明了上皮内肥大细胞(intraepithelial mast cell)通过肥大细胞-上皮细胞互作驱动Gasdermin C切割激活并促进IL-33释放,从而放大2型免疫反应的机制(Yang et al. Immunity 2024)。而肠道上皮簇细胞此前被认为主要发挥2型免疫“启动器”功能,通过建立“簇细胞-IL-25-ILC2s”正反馈环路启动并放大保护性2型免疫反应。然而,作为2型免疫反应上游的关键启动细胞,簇细胞是否同时具备负向调控的“刹车”功能以维持免疫稳态平衡,目前尚未明确。
本研究揭示了簇细胞一类已知能够起始2型免疫反应的特化上皮细胞,同时具备抑制2型免疫反应的调控功能。在本研究中,研究团队首先发现转录因子Spi-B在簇细胞中特异性高表达。通过构建肠道上皮细胞及簇细胞特异性Spib基因敲除小鼠模型,研究者们观察到即便在无病原体感染的条件下,Spib缺失小鼠也会产生自发性2型免疫炎症特征,包括簇细胞增生(图1)、抗寄生虫效应分子表达上调,以及类似寄生虫感染的肠道组织重塑。
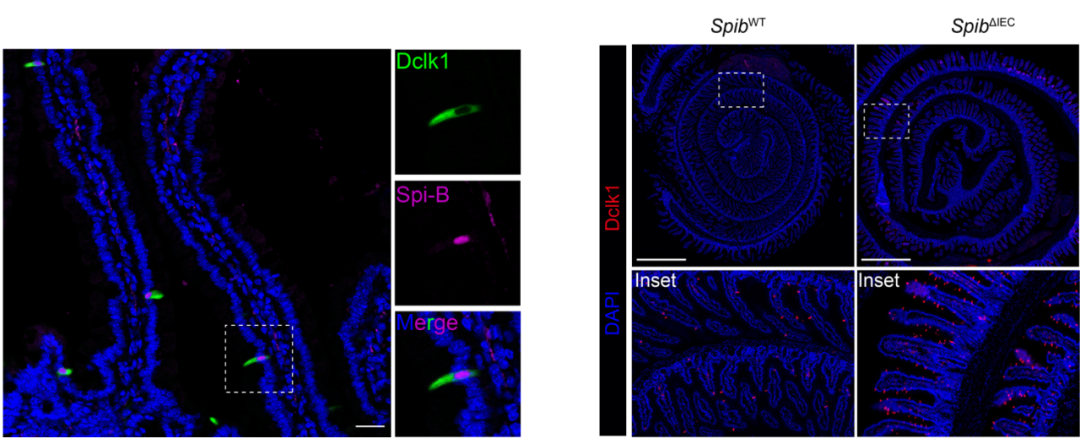
图1. Spi-B特异性高表达在簇细胞中且其缺失导致小肠簇细胞增生
进一步研究显示,簇细胞特异性Spi-B缺失小鼠不仅在寄生虫感染条件下表现出增强的2型免疫反应,且原本对食物过敏具有耐受性的C57BL/6J小鼠在Spi-B缺失后亦在食物过敏模型中呈现显著的过敏敏感性表型。在机制层面,通过整合簇细胞转录组学分析和Spi-B的DNA结合图谱,研究团队发现Spi-B通过抑制c-Kit信号驱动的关键警报素TSLP(Thymicstromal lymphopoietin)的产生(图2),进而调控Th2细胞依赖的2型免疫反应。
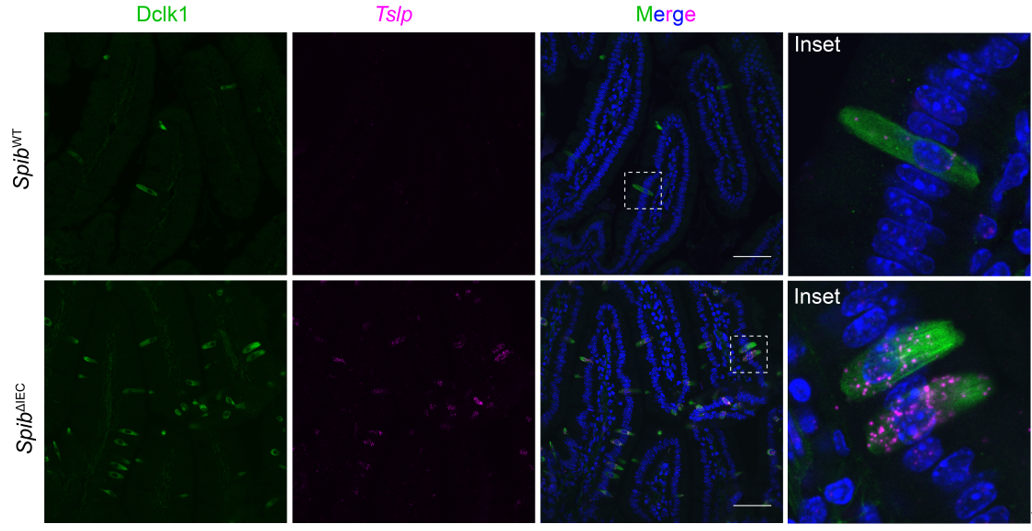
图2.小肠簇细胞是Spib缺失小鼠中TSLP的主要细胞来源
当这一簇细胞内源性负调控机制被破坏时,“簇细胞-TSLP-Th2”正反馈环路被异常激活,导致簇细胞增生和2型炎症反应的加剧。重要的是,这一病理过程可通过药物干预过度激活的c-Kit信号通路和过量产生的TSLP得到有效控制。总结而言,本研究不仅揭示了簇细胞在2型免疫中具有内源性抑制功能,更明确了簇细胞内在的“Spi-B-c-Kit-TSLP”调控轴在维持2 型免疫平衡中的关键作用(图3),并为开发针对 2 型免疫相关疾病的治疗方法奠定了重要的科学基础。
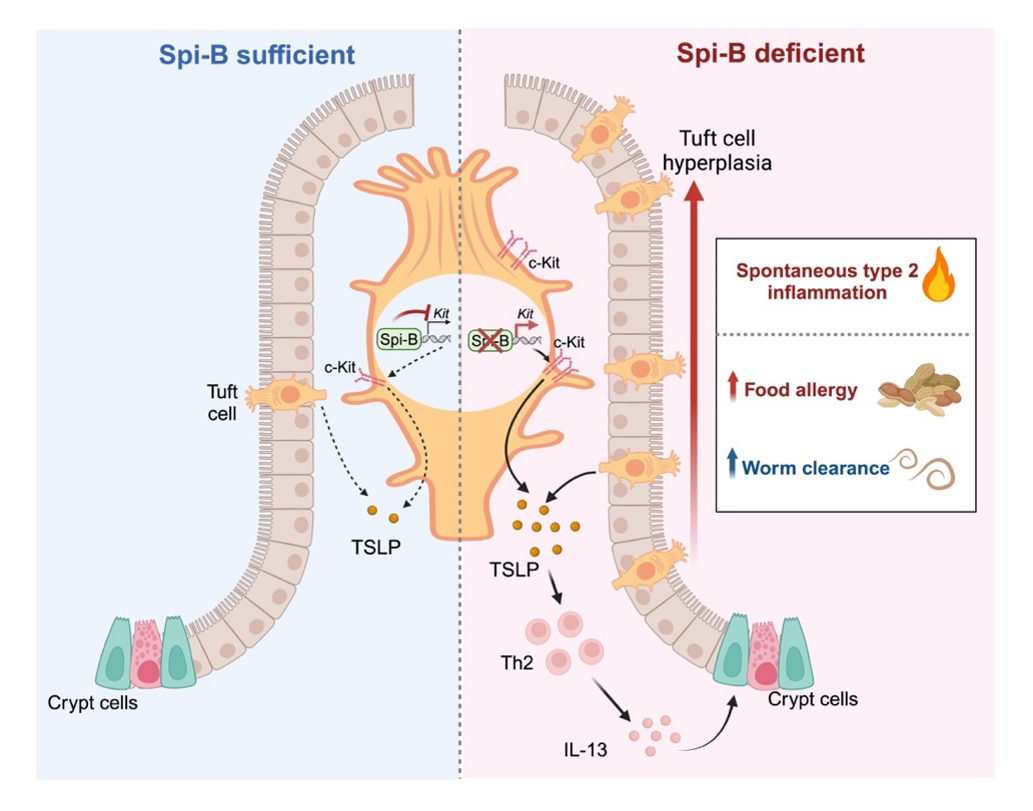
图3.以簇细胞为中心的2型免疫检查点
西湖大学医学院胡小玉教授和首都医学科学创新中心肿瘤研究所郭雪坤副研究员为本文的共同通讯作者。清华大学基础医学院博士生王佳丽为论文第一作者,博士生申若曦、阳昆鹏为课题的实验提供了重要帮助。本研究得到了清华大学基础医学院郭晓欢副教授、广州实验室于京佑研究员、美国国立卫生研究院吴船教授的重要支持。本研究得到了国家重点研发计划项目、国家自然科学基金项目、清华大学-北京大学生命科学联合中心和广州实验室的资助。

















