
医学院 新闻动态
索氏梭菌(Paeniclostridium sordellii)是一种可以引发急性感染的革兰氏阳性细菌,环境分布广泛。索氏梭菌感染不多见却非常致命,可引发毒血症,气性坏疽,低血压和休克等症状,尤其对于分娩或流产的女性风险极高,急性感染发生后的致死率近100%。索氏梭菌含致死毒素(TcsL)和出血毒素(TcsH)两种外毒素,其中致死毒素被认为是造成其高致死率的主要毒力因子。
组合重复寡肽(Combined Repetitive Oligopeptides, CROPs)是一段位于TcsL羧基端的重复序列结构。该结构目前发现仅存在于包括TcsL在内的大部分大梭菌毒素家族蛋白中,然而一直以来人们对其在毒素蛋白中的功能了解甚少。
北京时间2023年12月19日,陶亮团队与合作者在Nature Communications上在线发表题为“Structural dynamics of CROPs control the stability and toxicity of Paeniclostridium sordellii lethal toxin”的研究论文(图1),揭示了TcsL的组合重复寡肽区域具有调控毒素自剪切和毒性的功能,并从生化、细胞和结构层面阐述了其工作机制;研究还进一步发现这种自调控机制在其它大梭菌毒素家族成员中也可能普遍存在。
文章链接:
https://www.nature.com/articles/s41467-023-44169-z
 图1. 论文截图
图1. 论文截图
为了探究组合重复寡肽结构域的功能,研究团队首先在枯草芽孢杆菌系统中表达了全长和组合重复寡肽缺失的TcsL蛋白。期间团队成员发现了一个有趣的现象:组合重复寡肽缺失的TcsL在蛋白纯化过程中会自发进行切割。通过质谱分析和突变实验证实切割位点位于543位的亮氨酸和544位的甘氨酸,这是TcsL中的半胱氨酸蛋白酶的自剪切位点。在全长蛋白中,需要较高浓度的六磷酸肌醇(InsP6)才能激活半胱氨酸蛋白酶的自切割活性,这说明缺失组合重复寡肽结构会造成TcsL中的半胱氨酸蛋白酶活性失控变得过度活跃(图2)。
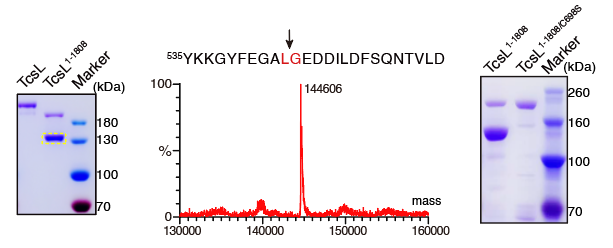
图2. 缺失组合重复寡肽区域会造成TcsL中半胱氨酸蛋白酶活性失控
为了进一步分析组合重复寡肽区域中抑制半胱氨酸蛋白酶活性的序列位点,研究者们构建了一系列毒素的截短和突变体,通过InsP6诱导的体外酶切实验,发现不同长度的组合重复寡肽片段对半胱氨酸蛋白酶的活性有着不同程度的影响。更有趣的是,缺失了组合重复寡肽的TcsL在细胞上的毒性甚至高于全长TcsL,说明该结构区域还影响了毒素的细胞毒性(图3)。
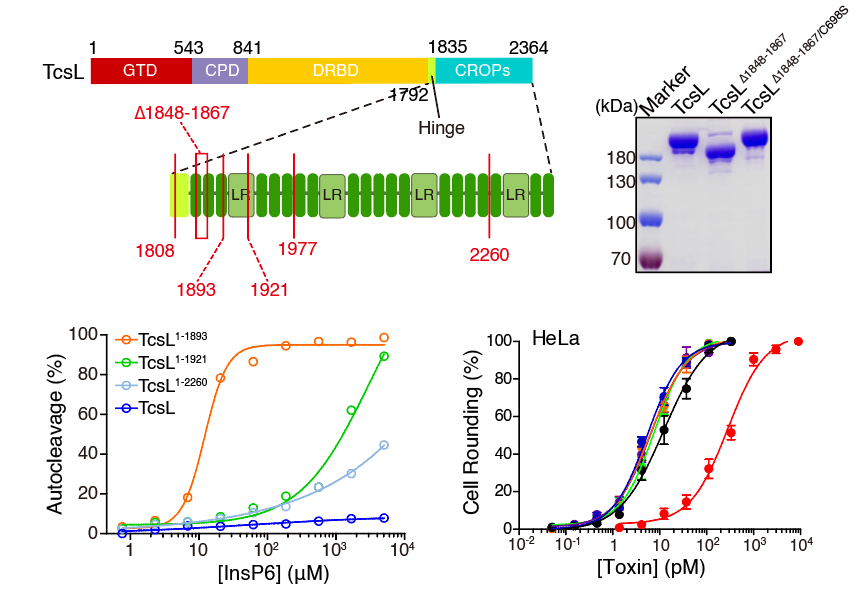 图3. 不同长度的组合重复寡肽对TcsL自剪切和细胞毒性的影响
图3. 不同长度的组合重复寡肽对TcsL自剪切和细胞毒性的影响
之后,陶亮团队与施一公团队开展合作,利用冷冻电镜单颗粒三维重构技术解析了在中性条件下和酸性条件下TcsL全长蛋白的三维结构。研究者发现,在中性条件下,TcsL呈现一种开放式的构象;而在酸性条件下,组合重复寡肽区域会发生近180°的旋转,形成一种关闭式的构象。其中关闭式的构象中,组合重复寡肽区域与其它结构域之间产生了两个分子内的互作界面,从而牢牢地“锁住”了毒素的其它区域(图4)。
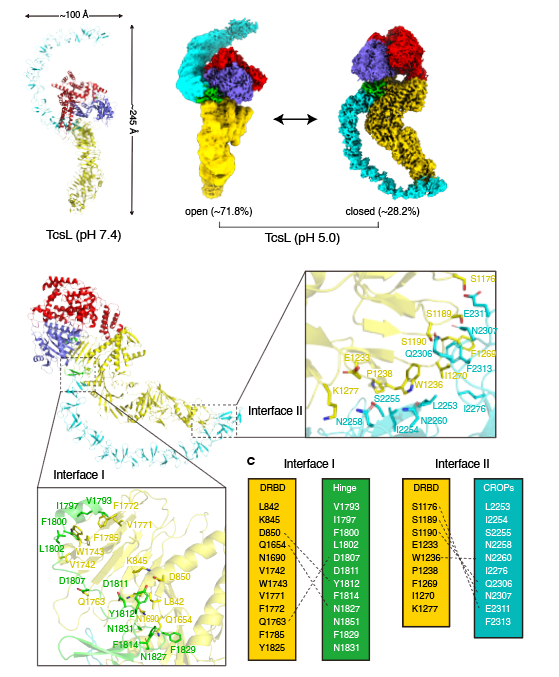
图4. TcsL存在开放和关闭这两种不同的构象,其中关闭式构象会形成两个分子内作用界面
接下来,研究者们模拟了TcsL释放到环境中,之后再接触宿主的情形。利用小鼠攻毒模型结合病理分析,研究者发现缺少组合重复寡肽区域的TcsL在存在InsP6的环境中暴露仅仅20分钟即会完全失活,这对于一种外毒素来说是不可接受的缺点。而全长的TcsL在类似环境下30分钟也不会有任何活性损失(图5)。最后,研究者们还将这一规律在大梭菌毒素家族的其他成员,包括TcdA,TcdB,TcsH和Tcnα中进行了验证,发现它们的组合重复寡肽区域也有着类似的作用。
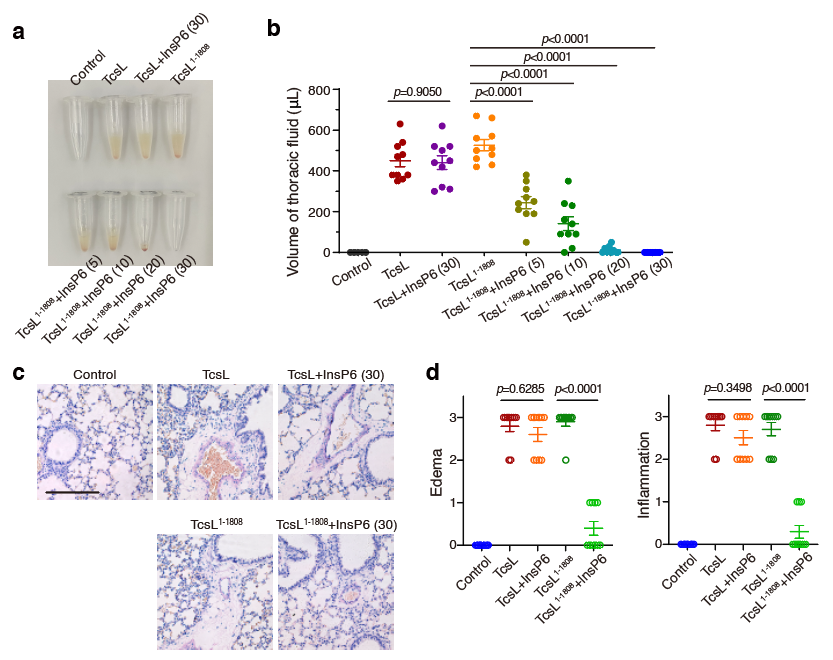
图5. 缺少组合重复寡肽区域的TcsL很容易在接触宿主前就发生失活
基于上述发现,研究者们提出了一种组合重复寡肽区域调控TcsL及其它大梭菌毒素稳定性和毒性的模型(图6)。作为一类外毒素,TcsL在被细菌释放到胞外后将面临各种复杂的环境条件。毒素可能以开放和关闭两种构象存在,其中开放式构象的组合重复寡肽区域舒展,暴露出毒素的核心区,这种构象对于攻击宿主细胞更为有利。而在一些相对严厉的条件下(如低pH值等),毒素倾向于转变为关闭式的构象,这种构象分子结构更为紧密和牢固,不易发生自剪切和降解。这种构象更利于维持毒素的稳定性和活性,直至毒素分子接触到其目标宿主细胞。
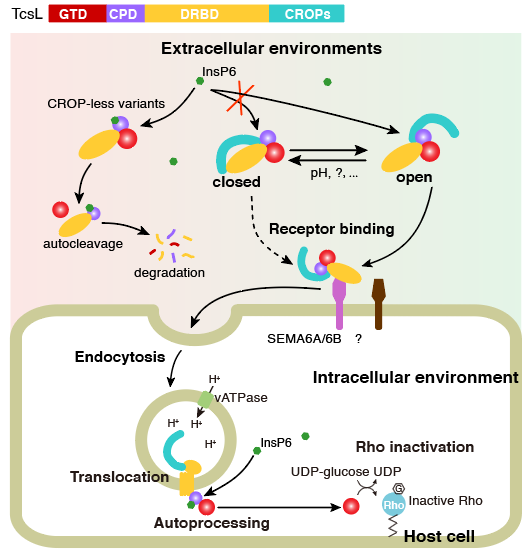
图6. 研究者提出的组合重复寡肽自调控毒素分子稳定性和毒性的模式图
西湖大学医学院/生命科学学院研究员陶亮和西湖大学生命科学学院副研究员占谢超(施一公团队)为本文的共同通讯作者;周瑶博士(陶亮团队)和占谢超博士为本文的共同第一作者。其他合作作者还包括西湖大学的李颜颜、张晓峰、罗建华、李谛音、周若瑜、张嘉豪、潘振瑞、张媛媛和贾田惠;另感谢波士顿儿童医院的董民教授和武汉大学的陈朋教授对本研究的支持和帮助。课题受到了国家重点研发计划、国家自然科学基金、浙江省自然科学基金、西湖基因组编辑中心、博士后创新人才支持计划、西湖实验室(生命科学和生物医学浙江省实验室)的资助;项目实施还得到了西湖大学生物医学实验技术中心、实验动物中心和高性能计算中心的支持和帮助。
西湖大学微生物宿主交互实验室(实验室主页:https://tao.lab.westlake.edu.cn/)致力于研究微生物-宿主之间的相互作用方式和内在规律,尤其是从分子、生化、细胞、病理、遗传等多角度研究重要病原细菌及其致病因子对宿主的影响及作用机制。西湖大学医学院/生命科学学院研究员陶亮近年来以通讯作者在Cell、Cell Research、Nature Microbiology、Nature Communications、PLOS Pathogens等学科主流期刊上发表多篇学术论文。实验室长期招收博士后、博士生和科研助理,方向包括且不限于微生物学、细胞生物学、化学生物学、分析组学、免疫学等,诚邀各方青年才俊加入、携手共同成长!有意者请联系陶亮博士(taoliang@westlake.edu.cn)。

















