医学院 新闻动态
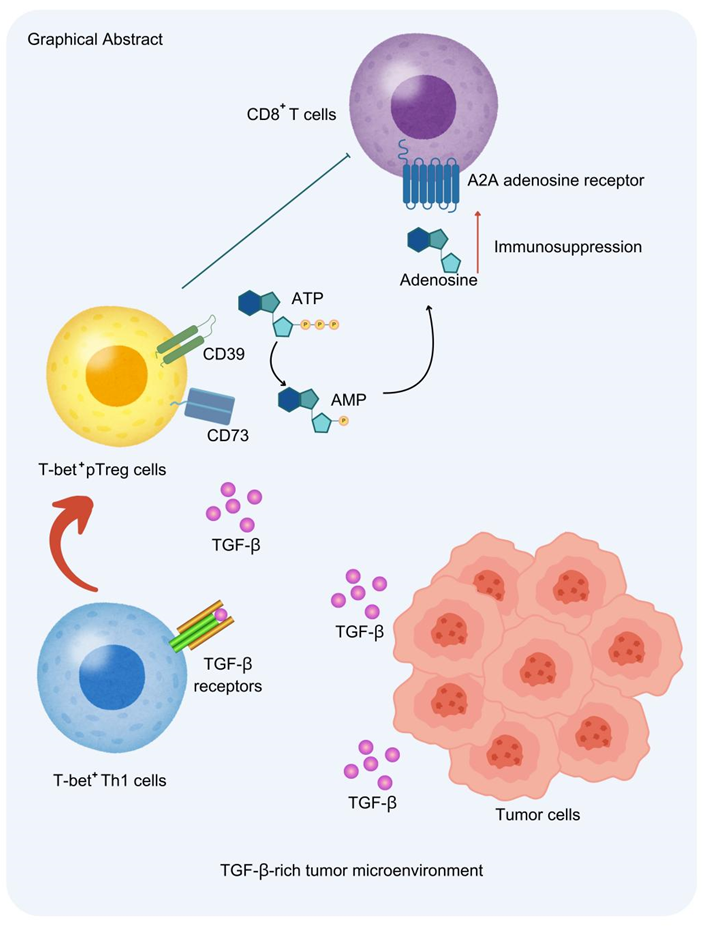
2025年2月5日,西湖大学医学院董晨团队在Journal of Experimental Medicine上发表了题为“Regulatory T cells converted from T helper 1 cells in tumors suppress cancer immunity via CD39”的研究论文。该研究深入解析了肿瘤内调节性(Treg)细胞的发育路径与功能特性,揭示了T-bet+ Treg细胞在肿瘤免疫中的关键作用,发现这些细胞通过高表达CD39抑制CD8 T细胞的功能,并提出了通过靶向T-bet+Treg细胞来增强抗肿瘤免疫反应的潜在策略,为癌症免疫治疗开辟了新的方向。
文章链接:
https://doi.org/10.1084/jem.20240445
尽管调节性T(Treg)细胞在维持免疫耐受性中至关重要,但在肿瘤微环境中,它们的免疫抑制作用使肿瘤细胞能够逃脱免疫系统的监视,这使得研究肿瘤内Treg细胞的作用变得尤为关键。近年来,肿瘤微环境被发现能够促进Treg细胞的招募和发育,这一过程对肿瘤免疫逃逸至关重要。大量研究发现,肿瘤浸润的Treg细胞在许多癌症中显著增多,并且Treg细胞与CD8+ T细胞的比例升高往往与癌症患者的不良预后相关。尽管如此,肿瘤微环境中Treg细胞的功能及其来源仍缺乏系统的研究。
肿瘤浸润的Treg细胞被认为是癌症免疫治疗的潜在治疗靶标。然而,系统性去除Treg细胞可能引发自体免疫反应。靶向Treg细胞上恒定表达的分子可能导致自体免疫副作用。因此,识别并选择性地靶向肿瘤微环境中主要的Treg细胞亚群至关重要。
根据来源,Treg细胞可分为两种亚群,即胸腺来源的天然Treg(tTreg)细胞和外周诱导的Treg(pTreg)细胞。tTreg细胞在胸腺内通过T细胞受体(TCR)与自我肽/主要组织相容性复合体(MHC)之间的高亲和力相互作用筛选生成。而pTreg细胞则是从常规CD4+ T细胞在TCR刺激和转化生长因子(TGF)-β及白介素(IL)-2的作用下在外周产生的。FOXP3转录因子是这两种Treg细胞的标志,并且对它们在胸腺和外周的细胞谱系承诺或分化至关重要。有研究表明,神经元蛋白1(NRP1)可能作为tTreg细胞的特异性标志。尽管Treg细胞在肿瘤微环境中的积累已被长期报道,但肿瘤浸润Treg细胞的来源依然是一个存在争议并亟待解答的研究问题。
在应对环境信号时,Treg细胞可能表现出可塑性,并表现出类似于CD4+辅助T细胞的表型。最早在感染结核分枝杆菌的实验鼠中发现,T-bet+ Treg细胞在炎症部位积累,抑制Th1介导的炎症反应。类似地,在单核细胞增生李斯特氏菌感染的实验鼠中,T-bet+ Treg细胞在次级淋巴器官中富集,抑制Th1型炎症反应。此外,T-bet+ Treg细胞还在人的咽喉癌、非小细胞肺癌(NSCLC)及小鼠肺肿瘤模型的肿瘤微环境中被发现,同时在炎症性肠病(IBD)和葡萄糖苷酸盐(DSS)诱导的结肠炎模型患者的肠道中也有类似现象。然而,T-bet+ Treg细胞在癌症中的发育过程和功能仍缺乏深入研究。
肿瘤微环境中pTreg细胞的积累
该研究对多种小鼠肿瘤模型中的Treg细胞亚群进行了分析。研究人员使用NRP1作为标记,区分了胸腺来源的tTreg细胞和外周诱导的pTreg细胞。研究发现,在淋巴结和脾脏中,大部分Treg细胞为NRP1+(即tTreg细胞),但在肿瘤中,超过一半的Treg细胞为NRP1-(即pTreg细胞)。通过过继转移实验,进一步验证了这一结果。实验表明,肿瘤中的Treg细胞约有50%是pTreg细胞,这些细胞来源于常规CD4+ T细胞。相比之下,淋巴结和脾脏中的Treg细胞主要为tTreg细胞。研究表明,肿瘤微环境可能通过促进pTreg细胞的积累,导致免疫抑制。
pTreg细胞在促进肿瘤生长中的重要作用
该研究接着探讨pTreg细胞在肿瘤免疫中的作用。研究人员通过过继转移方法选择性去除pTreg细胞,利用Foxp3DTR小鼠和白喉毒素(DT)去除pTreg细胞,而不影响tTreg细胞,从而避免自身免疫反应。结果表明,去除pTreg细胞后,肿瘤生长被抑制。与此同时,肿瘤浸润性CD8+ T细胞数量增加,并表现出更强的增殖能力和溶细胞活性。此外,肿瘤微环境中的髓系细胞群体比例发生变化,TAMs和单核细胞减少,中性粒细胞增多。进一步的治疗评估发现,在E.G7肿瘤模型的晚期去除pTreg细胞后,肿瘤生长得到抑制,CD8+ T细胞比例增加,且肿瘤浸润的CD8+ T细胞在总活细胞中的比例上升,特别是IFN-γ、颗粒酶B和CD107a的细胞比例。总体而言,去除pTreg细胞对荷瘤小鼠产生了有效的治疗效果。
肿瘤内Treg细胞高度表达T-bet转录因子
接着,该研究分析了肿瘤内Treg细胞是否在基因表达上与任何Th亚群相似,通过RNA测序对来源于Hepa1-6和E.G7小鼠肿瘤模型的肿瘤内Treg细胞进行转录组分析。结果表明,肿瘤内Treg细胞表现出Th1特征基因(如Tbx21和Ccr5)的上调,而Th2和Th17基因(如Gata3、Rorc和Ccr6)则下调。此外,肿瘤内Treg细胞的Nrp1表达低于淋巴结中的Treg细胞。进一步的流式细胞术分析显示,肿瘤内Treg细胞高度表达T-bet,但不表达RORγ t、BCL6或GATA3。T-bet+NRP1- Treg细胞占肿瘤内Treg细胞的60%。总体而言,研究结果表明,T-bet+NRP1- Treg细胞是多个癌症模型中肿瘤内Treg细胞的主要群体。
肿瘤内T-bet+ pTreg细胞表现出增强的激活、增殖和抑制功能
进一步研究发现,肿瘤内的pTreg细胞与tTreg细胞相比,表现出更高水平的Th1相关基因上调。同时,pTreg细胞还表现出与Treg细胞抑制功能相关的基因上调,以及与激活、细胞周期调控和趋化因子受体相关的基因上调。研究人员还比较了肿瘤内pTreg细胞与肠道Treg细胞的基因表达特征,发现肿瘤内的pTreg细胞与肠道Treg细胞具有相似的基因表达谱,尤其是在非淋巴组织区域,如含有较高比例pTreg细胞的固有层中。这些结果表明,肿瘤内的T-bet+ pTreg细胞具有增强的激活、增殖和抑制功能,进一步强调了T-bet+ pTreg细胞在肿瘤微环境中的重要作用。
T-bet 对肿瘤内 pTreg 细胞的功能至关重要
该研究接着探讨了 T-bet 在肿瘤内 pTreg 细胞功能中的作用。通过生成特异性敲除 Tbx21 的 Foxp3YFP-cre Tbx21fl/fl 小鼠(KO组),并与 野生型小鼠(WT 组)进行对比,发现KO组肿瘤生长明显减缓,且肿瘤内 Treg 细胞数量显著减少。流式细胞术分析显示,T-bet 缺失后,肿瘤内的增殖性 Treg 细胞减少,CD8+ T 细胞的激活和增殖提升,且肿瘤内 CD8+ T 细胞与 Treg 细胞的比例增高。进一步的过继转移实验验证了 T-bet 在 pTreg 细胞功能中的关键作用。此外,将抗PD-1治疗与Treg细胞特异性敲除Tbx21联合使用,显著抑制了肿瘤生长,并延长了小鼠的生存期。总的来说,研究表明 T-bet 在肿瘤微环境中对 pTreg 细胞的功能至关重要,且其与抗 PD-1 治疗联合应用具有潜在的治疗效果。
Th1细胞通过TGF-β信号在肿瘤中转化为pTreg细胞
该研究进一步探讨了T-bet+ Treg细胞在肿瘤微环境中的来源和分化路径。研究人员使用IFN-γ命运映射小鼠肿瘤模型,并结合过继转移实验,揭示了Th1细胞在肿瘤中可转化为pTreg细胞。实验中使用TGF-β受体缺失小鼠,发现阻断TGF-β信号可抑制这一转化过程,同时抑制肿瘤生长。综上所述,研究表明,Th1细胞通过响应TGF-β信号通路在肿瘤微环境中转化为pTreg细胞。
肿瘤内的Tbet+ Treg细胞表现出抑制性促肿瘤特征
接着,研究人员通过单细胞转录组分析,进一步阐明了肿瘤内T-bet+ Treg细胞的发育过程及T-bet在该Treg细胞群体中的作用。研究使用Foxp3YFP-cre和Foxp3YFP-cre Tbx21fl/fl小鼠,并将其与常规CD4+ T细胞及无肿瘤淋巴结Treg细胞进行比较。基于基因表达数据,研究识别出五个不同的Treg细胞簇,分别代表不同的Treg细胞阶段或类型。其中,Th1样Treg细胞是最具主导地位的簇,占肿瘤内Treg细胞的至少70%。研究结果表明,Tbx21基因敲除导致Th1样Treg细胞减少,这一变化与抑制分子下调及Treg细胞功能丧失相关。进一步分析显示,T-bet缺失削弱了Treg细胞的抑制功能,尤其是CD39介导的代谢干扰功能。伪时间分析进一步证实,Th1样Treg细胞主要源自肿瘤内的Th1细胞和增殖性Treg细胞,表明TME中的Th1样Treg细胞是由Th1细胞转化为pTreg细胞。研究强调T-bet在维持Treg细胞抑制性及促肿瘤功能中的关键作用,并为肿瘤免疫治疗策略的开发提供了新的思路。
肿瘤内T-bet+ pTreg细胞高度表达CD39
该研究接着通过单细胞转录组学和流式细胞术,揭示了CD39在肿瘤内T-bet+ pTreg细胞中的特异性表达,并确定了CD39介导的免疫抑制作用是肿瘤内Th1样Treg细胞独特的机制。研究发现,Treg细胞在肿瘤中高度表达CD39,并与嘌呤代谢相关,暗示其在免疫抑制中的关键作用。CD39与CD73的共表达在肿瘤内Treg细胞中尤为突出,进一步表明T-bet+ pTreg细胞具有独特的免疫抑制标志。此外,CD39的表达也在其他含有pTreg细胞高比例的组织中发现,如小肠和结肠的固有层。研究结果提示,CD39可以作为选择性调节T-bet+ pTreg细胞的潜在治疗靶点,为癌症免疫治疗提供了新的策略。
癌症患者肿瘤中的Treg细胞显著共表达T-bet和CD39
接下来,该研究进一步验证了核苷酸代谢是否为肿瘤内Treg细胞在人体癌症中发挥免疫抑制功能的重要机制。通过分析人类乳腺癌组织的RNA测序数据,研究发现肿瘤内Treg细胞的差异表达基因与小鼠肿瘤模型相似,尤其涉及核苷酸代谢相关的通路。此外,研究还发现,ENTPD1基因(编码CD39)在多种癌症类型的肿瘤内Treg细胞中普遍上调。通过多种人类癌症的单细胞RNA测序数据,进一步证实了TBX21(编码T-bet)与ENTPD1在多种癌症类型(如鼻咽癌、乳腺癌、黑色素瘤、鳞状细胞癌、肝细胞癌和结直肠癌)的肿瘤内Treg细胞中特异性共表达。流式细胞术分析也验证了肝癌患者样本中肿瘤内Treg细胞高度共表达T-bet和CD39。这些结果表明,T-bet和CD39的共表达是一种跨越多种人类癌症的免疫抑制机制,与小鼠肿瘤模型的发现相一致。这一新发现为开发针对肿瘤内T-bet+ pTreg细胞的靶向治疗提供了理论基础,有望克服癌症中的免疫抑制。
靶向CD39能够激发抗肿瘤反应并增强抗PD-1治疗效果
综上所述,该研究探讨了肿瘤微环境中Treg细胞的起源、功能及其免疫抑制机制,重点分析了T-bet+ pTreg细胞在肿瘤免疫中的关键作用。研究发现,这些Treg细胞主要来源于Th1细胞在TGF-β信号作用下转化,并通过CD39介导的代谢干扰抑制CD8+ T细胞功能。靶向CD39能够选择性地抑制T-bet+ pTreg细胞的免疫抑制作用,而不影响免疫稳态。该研究为癌症免疫治疗提供了新的策略,有望在不引发自身免疫反应的情况下增强抗肿瘤免疫反应,推动精准免疫治疗的进展,预示着癌症免疫治疗的新突破。