
医学院 新闻动态
早产(指妊娠不足37周的分娩)是全球范围内新生儿死亡的首要原因,严重威胁儿童健康并带来较大社会负担。尽管医学进步显著提高了早产儿的生存率,但关于如何预测及预防早产,人们仍缺乏深入的认识。同时,对维持足月妊娠的生物学机制,科学界的理解也仍然有限。分娩发动是一个受多因素调控的复杂生理过程,由母体遗传背景与环境暴露共同影响。近年来,母体微生物,尤其是肠道微生物,作为外部环境暴露的“窗口”,逐渐成为解析生命早期健康影响因素的重要研究对象。在孕期,母体经历一系列生理适应性变化,包括消化、内分泌和免疫系统的重塑,而肠道微生物不仅是这些变化的响应者,也可能作为主动调控者影响妊娠结局。已有研究表明,女性生殖道菌群失衡与早产风险密切相关,但肠道微生物在早产中的作用及相关机制仍缺乏系统研究。
北京时间2025年9月10日,西湖大学医学院郑钜圣团队与合作者在期刊《Cell Host & Microbe》发表了最新研究成果:“Maternal gut microbiome during early pregnancy predicts preterm birth”。该研究基于孕妇队列(涵盖5,313名志愿者)进行深入多模态表型及基因型整合分析,发现了妊娠早期肠道微生物特征与早产风险的直接关联,并揭示母体妊娠早期的肠道微生物能够强化早产的宿主遗传风险。研究进一步鉴定出一种关键的肠道细菌-无害梭菌(Clostridium innocuum)可作为孕早期预测早产的新型生物标志物,并通过系统的功能学实验阐明了该菌降解17β-雌二醇的作用机制(图1)。以上发现为早产的早期预警提供了新型微生物标志物和干预靶点,也为未来制定针对性的早产预防策略奠定了科学基础。
全文链接:
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(25)00330-0

文章首页截图
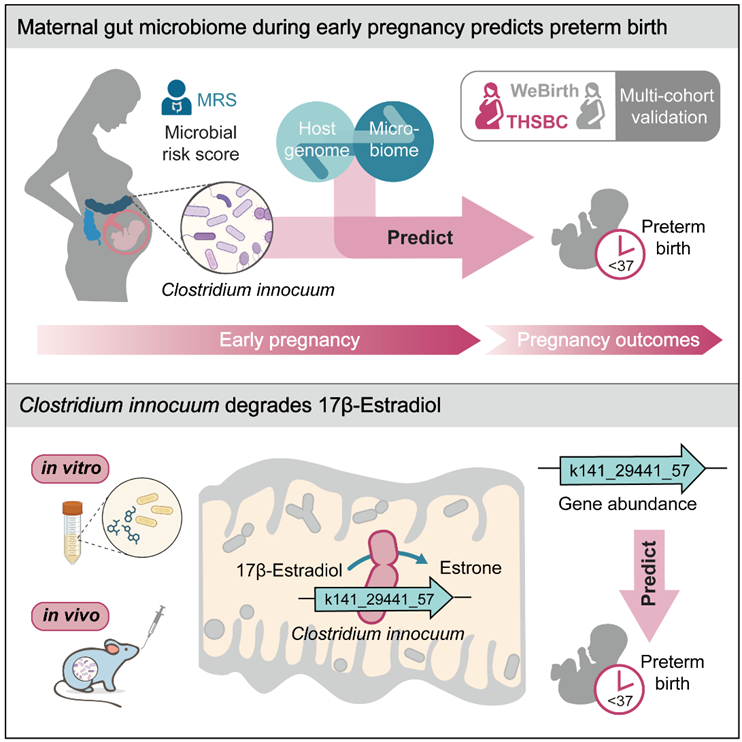
图1. 研究总结示意图
该项目依托多个出生队列开展:同济-华西-双流出生队列(Tongji-Huaxi-Shuangliu Birth Cohort,THSBC)及西湖精准出生队列研究(Westlake Precision Birth cohort,WeBirth)以及广州出生队列。其中WeBirth是西湖大学主导建立的精细化出生队列研究。研究团队系统收集并分析了发现队列(THSBC)中4,286名孕妇的孕早期肠道菌群、宿主基因组、性激素等多维数据,并对所有参与者持续随访至分娩阶段。为揭示孕早期肠道菌群与妊娠结局的关联,研究团队开展了微生物组关联分析(Microbiome-wide association study)。结果发现,11个菌属和1个菌种与早产风险相关;另有6个菌属和1个菌种与孕期长短存在显著关联(图2A)。值得关注的是,在菌种层面,无害梭菌Clostridium innocuum与早产风险的正相关性最为显著。这一关联在独立队列(WeBirth)中成功进行了验证。
在锁定与早产相关的关键菌群后,研究团队进一步推进相关结果在临床风险评估上的应用,分别在菌属和菌种水平构建了早产的微生物风险评分(Microbial risk score,MRS,图2B-2C)。在THSBC队列和WeBirth队列中,构建的MRS均能显著预测早产风险。例如,基于属水平数据构建的MRS,在两个队列中的比值比(OR)分别为2.65(95% CI:2.26–3.11)和1.47(95% CI:1.02–2.11)。
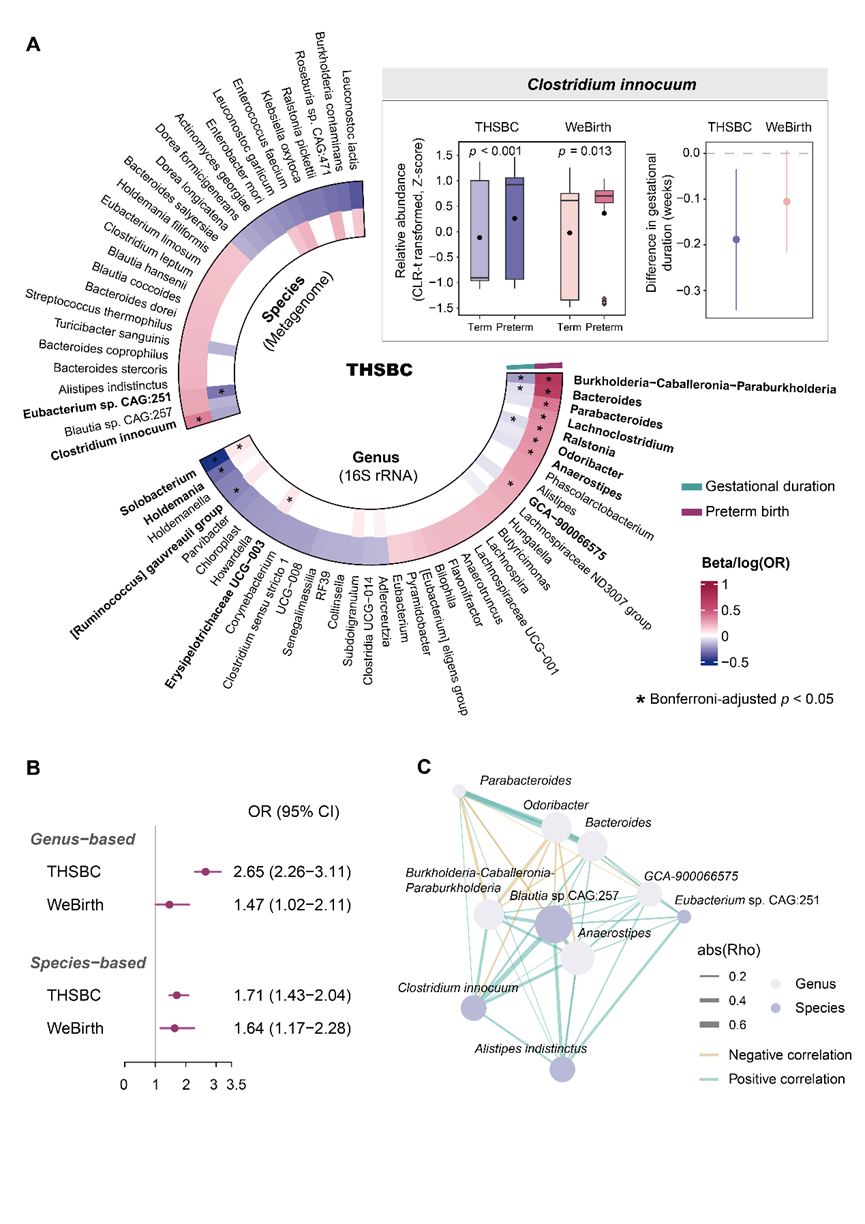
图2. 孕早期母体肠道微生物组成与早产的关联
除肠道菌群外,已有研究提示母体宿主基因组同样参与调控分娩发动。为此,本研究采用系统生物学整合分析的策略,探讨了母体宿主遗传风险与微生物风险对早产的协同作用。针对东亚人群早产遗传背景尚不明确的问题,团队首先基于发现队列开展了孕期长短与早产的全基因组关联分析(Genome-wide association study,图3A),相关结果在广州出生队列等外部队列中进行了验证,并据此构建了早产的多基因风险评分(Polygenic risk score,PRS,图3B)。在进一步整合MRS、PRS及传统风险因素后,早产预测模型性能显著提升(图3C),表明母体MRS与PRS存在交互作用,两者对早产风险显示出累加影响。
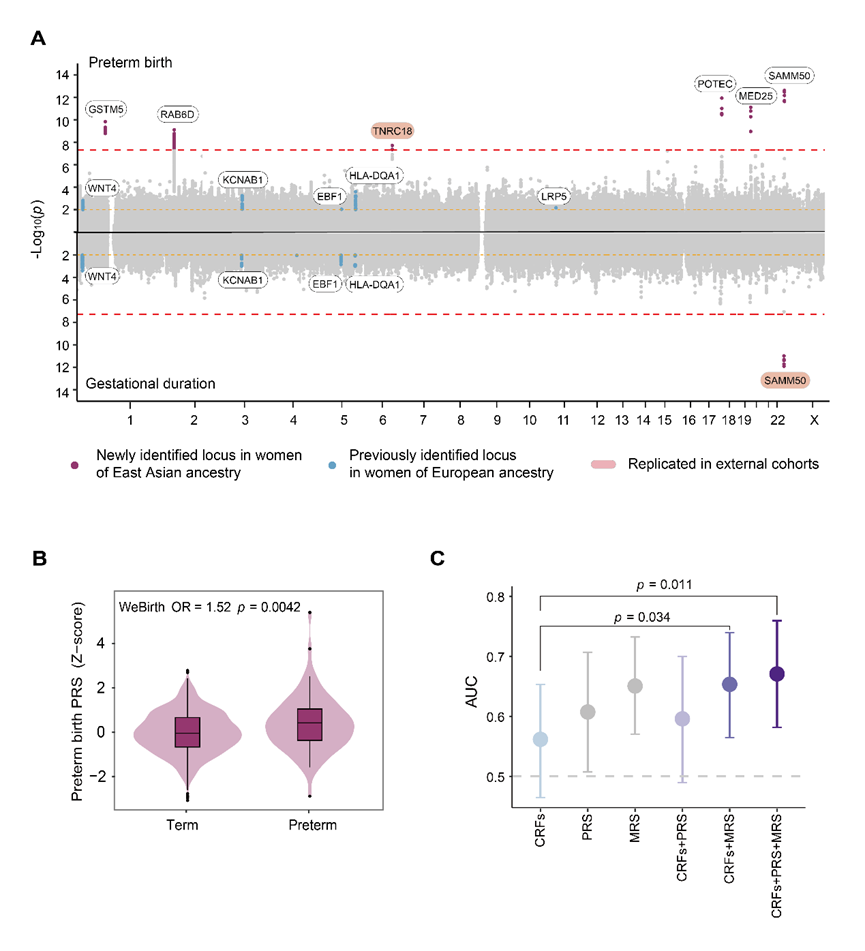
图3. 母体多基因风险与肠道微生物风险对早产的协同作用
PRS和MRS的联合预测性能并非简单叠加,提示两者间可能存在潜在的交互效应。研究团队进一步分析了二者的交互作用。该分析面临一项关键挑战:需从观测数据及极高维度的微生物组数据中有效识别出可靠的交互信号。为解决这一难题,团队采用双重机器学习方法(Double Machine Learning,DML)这一因果推断方法,基于观察性数据识别宿主基因-肠道微生物间的交互作用(图4A)。DML能够在高维协变量环境中,有效估计特定干预(或暴露)对结局的效应是否受其他变量的修饰,尤其适用于像微生物组这样复杂高维的数据结构。研究结果显示,随着MRS的增加,PRS对早产的影响显著增强(图4B)。在发现和验证队列中,对比MRS较低的孕妇,MRS较高的孕妇中PRS与早产的关联强度更大(图4C)。有趣的是,在两个队列中,PRS与孕期长短的负相关关系在C. innocuum携带者中更为显著,而在非携带者中较弱(图4D-E)。这些发现表明母亲孕期MRS以及特定细菌可能是母亲宿主遗传风险影响早产的重要调节因子。
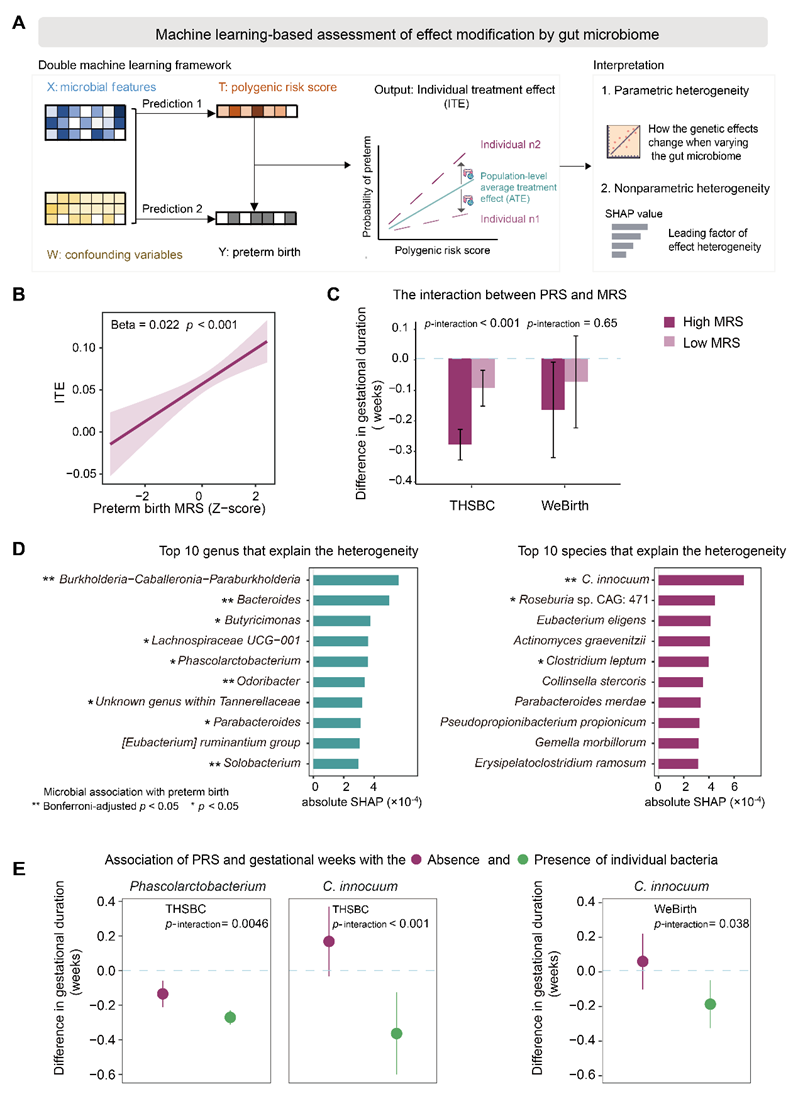
图4. 母体宿主遗传风险对早产的影响依赖于肠道菌群
在所有关联菌中,C. innocuum经多队列验证,不仅与早产直接相关,还能够调节母体遗传背景对早产风险的影响。为深入解析该菌在早产中的生物学机制,研究团队开展了一系列功能实验。在人群层面,团队基于THSBC队列发现该菌相对丰度与2-甲氧基雌酮及其孕期的增加程度均呈显著负相关(图5A)。在机制层面,研究人员利用体外共培养体系证明,C. innocuum能够有效降解17β-雌二醇,并将其转化为活性较弱的代谢产物雌酮(图5B)。进一步的体内实验通过ELISA检测发现,定植该菌的孕鼠体内雌二醇水平显著降低(图5C)。通过宏基因组功能预测、结构同源比较和分子对接分析(图5D-E),研究团队发现C. innocuum携带一个新型雌二醇降解基因(k141_29441_57)。异源表达实验证实,该基因编码的酶能够有效降解17β-雌二醇(图5F)。值得注意的是,该基因在早产孕妇的孕早期的粪便样本中已出现显著富集现象(图5G)。上述结果从人群观察到体内外功能验证,系统揭示了“肠道微生物-雌激素轴”在早产发生中的潜在作用机制。
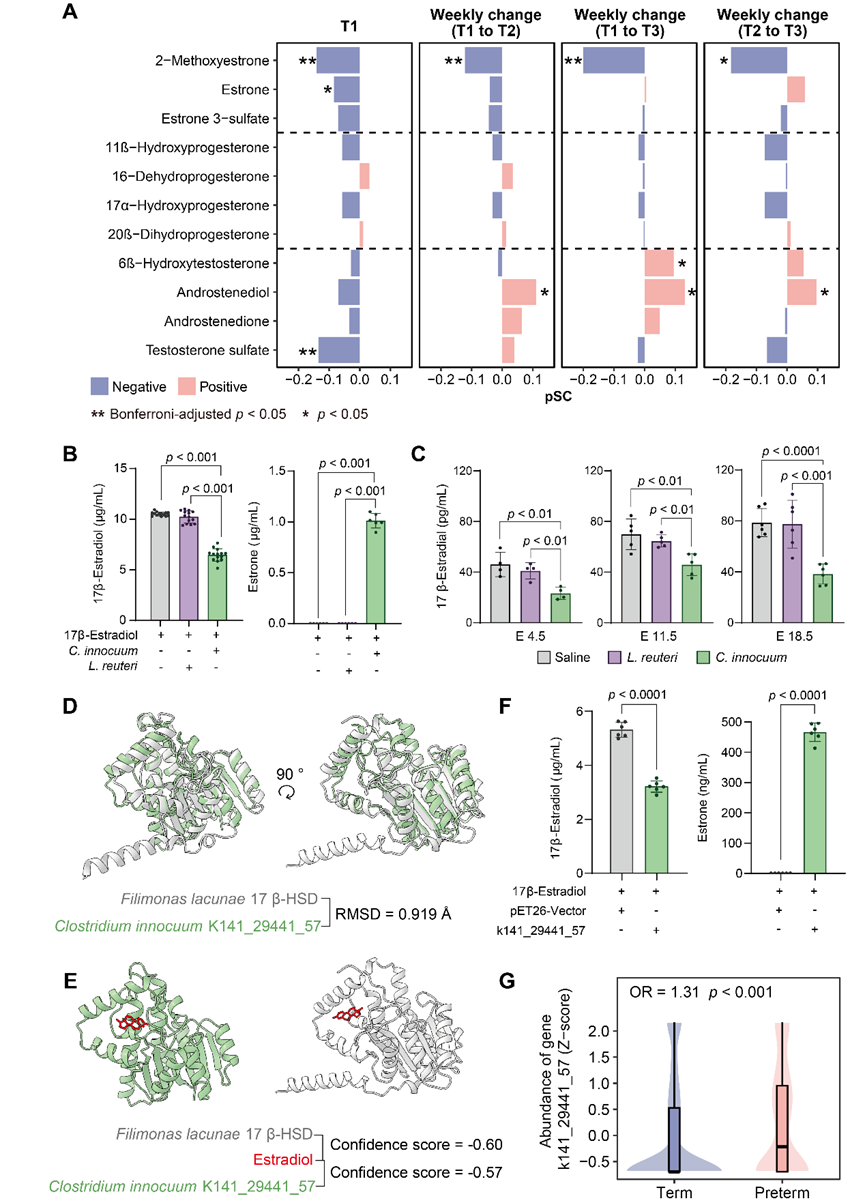
图5. C. innocuum作为宿主雌激素代谢的一个潜在微生物调节因子
该研究是迄今最大规模的孕期肠道微生物组研究之一,揭示孕早期肠道菌群特征与早产风险的关联,发现孕早期的无害梭菌及其雌二醇降解基因能够潜在预测早产,这一发现为早产的精准预测和个体化防控开辟了新的方向。
西湖大学医学院助理研究员苗泽蕾、博士生胡诗佳、访问学生陈天涞、华中科技大学博士后吴萍及博士生赖雨薇为该论文共同第一作者,西湖大学医学院郑钜圣、四川大学华西第二医院潘雄飞、华中科技大学同济医学院公共卫生学院潘安及广州医科大学附属妇女儿童医疗中心邱琇为该论文的共同通讯作者。课题受到了国家重点研发计划、国家自然科学基金、浙江省“尖兵”“领雁”研发攻关计划、浙江省自然科学基金及西湖实验室(生命科学和生物医学浙江省实验室)的资助;项目实施过程中还得到了西湖大学高性能计算中心、分子科学公共实验平台及实验动物中心的大力支持。
西湖大学精准营养与计算医学实验室介绍:
西湖大学精准营养与计算医学实验室(实验室主页:http://zheng.lab.westlake.edu.cn/)由郑钜圣担任PI,致力于运用人体和人群生物大数据,结合基因组、代谢组、微生物组和蛋白质组等技术手段,在人群层面探索发现人类疾病的全新营养或者药物干预靶点。近5年来,已经在肠道微生物组、营养及计算医学领域做出一系列原创性发现(Cell Host & Microbe 2025; Nature Metabolism 2025; Gut 2022, 2024; Cell Genomics 2025等)。欢迎有志者于精准营养或者计算医学等多学科交叉研究的朋友加盟(博士生、博士后等岗位)(email: zhengjusheng@westlake.edu.cn)。

















