
医学院 新闻动态
在免疫学研究领域,Tfh细胞作为CD4+ T细胞的一种重要亚群,因能特异性地辅助B细胞产生高亲和力抗体而备受瞩目。近日,董晨科研团队取得突破性进展,他们在 Nature Immunology 杂志在线发表了题为“Reciprocal regulation of T follicular helper cells and dendritic cells drives colitis development”的论文。该研究发现Tfh细胞在慢性肠炎中扮演着一个全新、独立于辅助B细胞成熟之外的关键角色,这为探索Tfh细胞的功能和治疗这类疾病打开了崭新的视角。
文章链接:
https://www.nature.com/articles/s41590-024-01882-1

研究介绍
自2009年由董晨和另外两个研究组分别鉴定了BCL6是Tfh细胞特异的转录因子以来,该细胞群体的发育机制和功能研究一直是科研前沿的热点。Tfh细胞的发育可以分为两个阶段:其第一阶段发育是在T细胞区域,在树突状细胞(DCs)的刺激下T细胞表达BCL6形成了早期的Tfh细胞,第二个阶段则是其进入生发中心(GC)辅助B细胞成熟以帮助其产生高亲和力的抗体。目前大量的研究主要集中在Tfh细胞在GC中的作用,而Tfh细胞是否能在GC以外发挥生物学功能尚不清楚。近年来,科研界密切关注到慢性炎症性疾病及自身免疫疾病中Tfh细胞的异常增多现象,传统的观点把这归咎于Tfh细胞帮助B细胞产生异常增多的抗体而致病。然而,在有些疾病中包括慢性炎症性肠病(IBD),并无异常增高的抗体,或者这类抗体更多的是疾病的标志而不是直接导致疾病的因素。在这种情况下Tfh细胞是否参与疾病的发病调控是未知的。
通过分析IBD患者的样本和T细胞诱导的小鼠慢性肠炎模型,研究人员发现肠道淋巴滤泡中富含有大量的Tfh细胞,这些细胞对于肠炎的进展至关重要。使用来源于Bcl6(fl/fl)Cd4cre 小鼠(Tfh细胞分化缺陷)的T细胞去诱导肠炎,结果显示Tfh细胞分化受阻时肠炎明显减轻,并且Tfh细胞的分化是肠道内的T细胞抗凋亡而促进肠炎进展的关键,同时这一作用是不依赖于B细胞而存在的。在此之后,研究人员使用了同样导致Tfh细胞分化缺陷的Notch2-/-Notch1-/-和Il21-/-T细胞进行了以上实验,进一步证实了以上的结论。
在肠道淋巴滤泡中的T细胞区,CD4+ T细胞与成熟的树突状细胞(DC)形成了一个有序的结构,该研究将这一结构称为“DC-T cluster”,这其中的CD4+ T细胞包含大量的表达BCL6的早期Tfh细胞,并且Tfh细胞的发育对DC-T cluster的形成和发展很重要。通过单细胞转录组测序分析,研究人员进一步证实了这一结构中Tfh细胞的存在,并且其已经具有了经典的Tfh细胞的特征。同时,单细胞转录组分析深入地揭示了BCL6的表达赋予了T细胞抗凋亡的特性。
在DC-T cluster中,DCs符合2型经典树突状细胞(cDC2)的特征,并且研究人员使用体外实验验证了这群DCs细胞可以促进Tfh细胞的分化。接下来,研究人员进行了小鼠体内实验,使用CD11b+ DCs缺陷的受体小鼠(Irf4-/-Rag1-/-)进一步验证了DC-T cluster中的这群DCs促进Tfh细胞分化是肠炎发展的关键。同时,在肠炎发展过程中,Tfh细胞促进了DC-T结构内的成熟的DCs的聚集。Tfh细胞可以表达更高水平的Lta和Ltb,后者可以形成LTa1LTb2二聚体而作用于DCs表面的的LTβR,促进成熟DCs的聚集。同时,该研究证明了LTβR 信号传导对成熟DCs聚集和肠炎发展的关键作用。因此,Tfh细胞和DCs的相互作用促进了DC-T cluster的发展和肠炎的进展(如下图)。
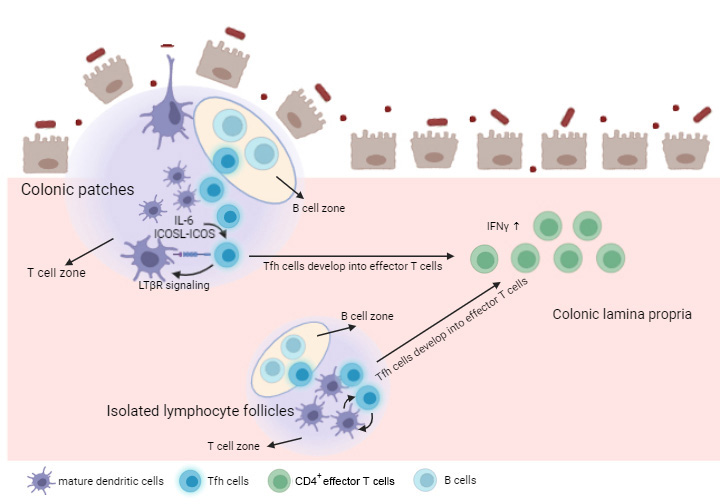
该研究接下来利用单细胞转录组分析和动物实验证明了Tfh细胞促进肠炎的一个关键的生物学功能:在这些淋巴滤泡中产生的Tfh细胞能够进入到肠道固有层内转变为效应性CD4+ T细胞(Teff)而促进肠炎。在这里,研究人员进一步使用了Bcl6cre-ert2/Rosa-tdtomato T细胞追踪了表达BCL6的Tfh细胞的转分化,结果证实了Tfh细胞转变成了一群不易凋亡的Teff细胞包括对肠炎发病很重要的Th1细胞,使其构成了肠道内炎症性CD4+ T细胞的主要来源(如上图),这也是触发肠炎病理变化的重要机制之一。
Tfh细胞以上的促进炎症发病的作用,并不是依赖于传统认知中的辅助B细胞产生高亲和力抗体而实现的,这项研究首次探讨了Tfh细胞在GC以外的生物学功能。它不仅为我们理解Tfh细胞在慢性炎症疾病中的作用提供了新的见解,也为我们开发新的治疗策略提供了方向。通过阻断IBD患者肠道内淋巴滤泡中的DC-Tfh相互作用,可能成为一种有效的治疗方法。
这一研究发表在最新一期的免疫学顶刊Nature Immunology上。上海市免疫治疗创新研究院的助理研究员,前清华大学博士后白雪是本研究的第一作者,西湖大学医学院董晨院士是这一研究的通讯作者,其他参与本研究的作者主要来自于清华大学医学院。本研究得到了国家自然科学基金、上海市科学技术委员会和新基石基金的大力资助。
最新资讯
新闻动态
新闻动态
新闻动态
董晨团队揭示Tfh细胞在慢性肠炎中的新角色

















