医学院陶亮、郑钜圣团队联合发现一类细菌特有氨基酸代谢物可预防肥胖
肥胖是全球性的公共卫生难题,影响着数亿人的健康。肥胖会显著升高多种人类疾病的患病风险,包括且不限于高血脂、动脉粥样硬化、2型糖尿病、脑卒中,甚至部分癌症。虽然目前人们已经清楚认识到肠道微生物与脂肪的摄入和代谢密切相关,但其背后的机制复杂,需要进一步研究探明。
北京时间2025年3月14日,西湖大学医学院陶亮团队、郑钜圣团队,联合中山大学陈裕明团队在国际知名期刊Nature Metabolism 杂志发表了题为“Human gut microbial aromatic amino acid and related metabolites prevent obesity through intestinal immune control”的研究论文。研究团队发现一类肠道细菌特有的芳香族氨基酸代谢物可以作用于肠道,通过调节肠道免疫来降低慢性炎症和脂肪吸收,达到预防肥胖的效果。该研究进一步拓宽了我们对肠道微生物影响宿主健康方式和机制的认知,并为预防肥胖提供了新的药物候选和方法开发策略。
文章链接:
https://www.nature.com/articles/s42255-025-01246-5
文章截图:

研究团队以一个中国人群的大型健康队列(广州居民营养与健康队列,GNHS)为基础,通过整合定量化的血清代谢组学与人体测量学数据,系统筛选出与肥胖表型密切相关的代谢物。值得注意的是,多个高关联性分子富集于一条细菌特有的苯丙氨酸-络氨酸分解代谢通路。该通路为部分细菌所特有,动物体内没有该代谢过程所需的酶。进一步分析聚焦到一个关键代谢分子4-羟基苯乙酸(4HPAA),发现其血清浓度与肥胖指标呈显著负相关。代谢网络动态分析揭示其上游前体分子呈现正向关联特征,而下游代谢产物未显示统计学关联,提示该分子在微生物-宿主共代谢过程中可能发挥独特的生物学调控功能(图1)。
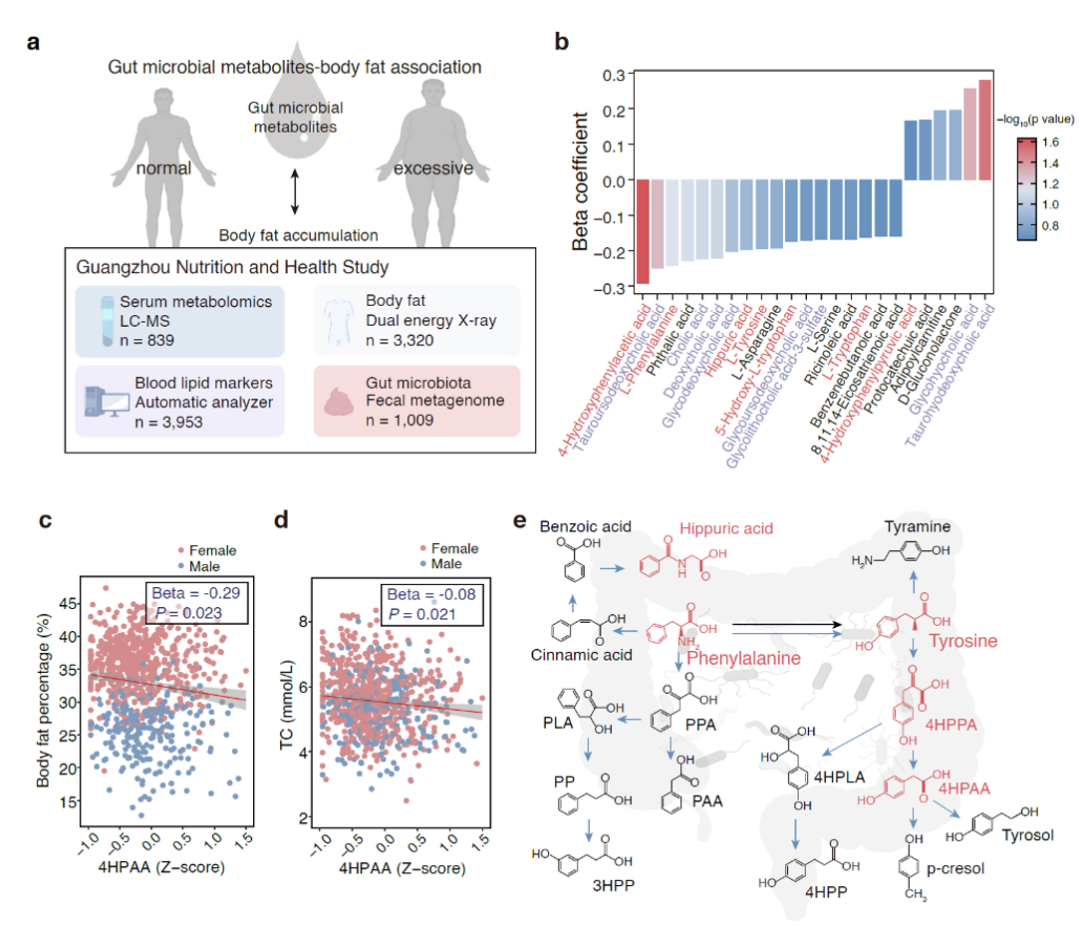
图1. 肠道细菌的芳香族氨基酸代谢物与人体肥胖指征有相关性本研究通过构建高脂饮食诱导的小鼠肥胖模型,通过预防与治疗双模型开展系统性验证实验,实验显示饲喂4HPAA的干预组较对照组体脂蓄积显著降低。更有意思的是,两种与4HPAA具有相似化学结构的小分子代谢物3HPP和4HPP也能起到类似预防肥胖的效果。除了体脂的显著下降,饲喂4HPAA和3HPP还能预防高脂饮食诱导的脂肪肝生成(图2)。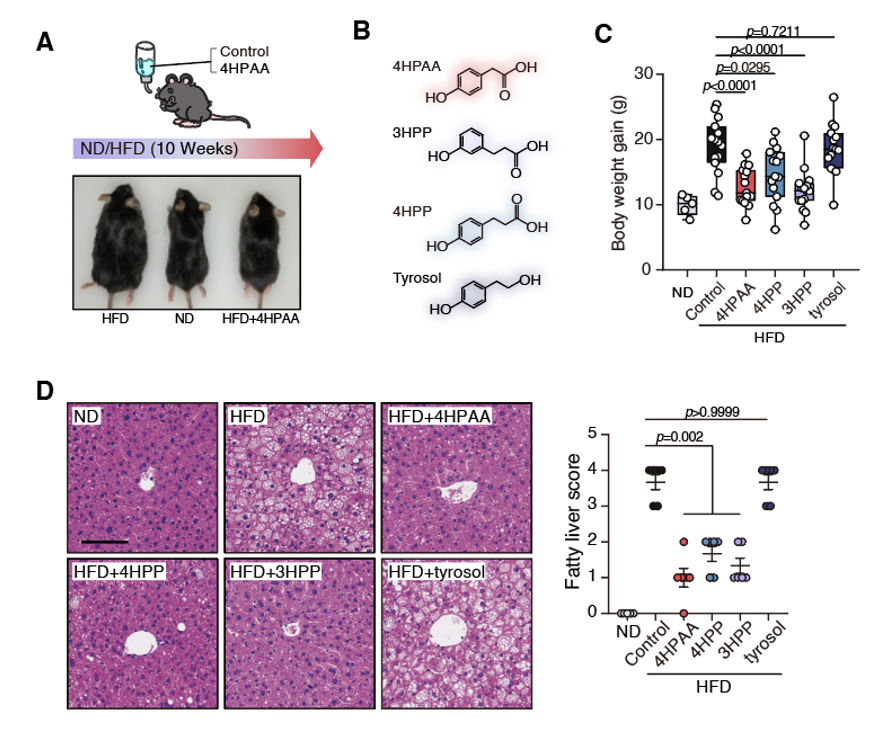
图2. 4HPAA及类似物可有效预防高脂饮食诱导的肥胖和脂肪肝。(A)4HPAA饲喂预防高脂饮食引发的小鼠肥胖。(B)4HPAA及其类似物的分子结构。(C)3HPP和4HPP也可以达到预防肥胖的效果。(D)4HPAA和3HPP还能预防脂肪肝形成。为了研究这些代谢物在体内作用的部位,研究者还尝试了通过腹腔注射的给药方式。有意思的是,即使给予更大剂量,腹腔注射也无法达到预防肥胖的效果,预示这些小分子代谢物的作用部位是肠道上皮(图3)。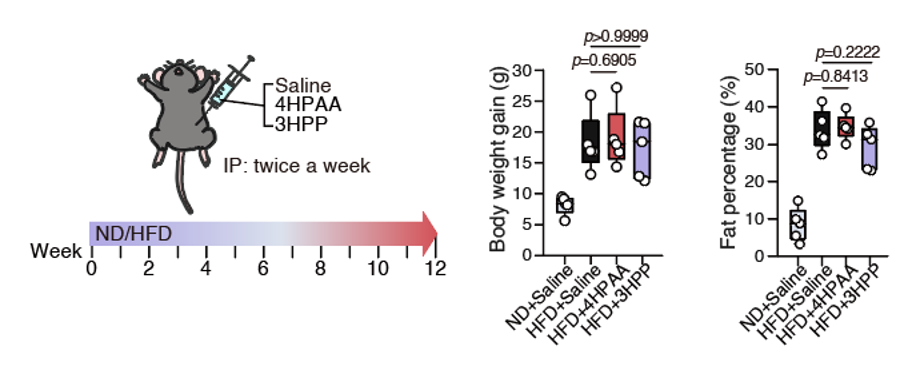
图3. 腹腔注射的给药方式不能预防高脂饮食诱导的小鼠肥胖为进一步明确芳香族氨基酸代谢小分子(4HPAA/3HPP/4HPP)的抗肥胖作用是否依赖肠道菌群介导,本研究通过无菌小鼠模型开展机制验证。结果表明,在肠道微生物缺失条件下,虽然差异变小,但饲喂了代谢物的干预组相较对照组仍可抑制小鼠肥胖的相关表型。该实验证明该代谢小分子可以直接作用于宿主进行调控,而非间接通过其它肠道微生物的介导作用来发挥功效(图4)。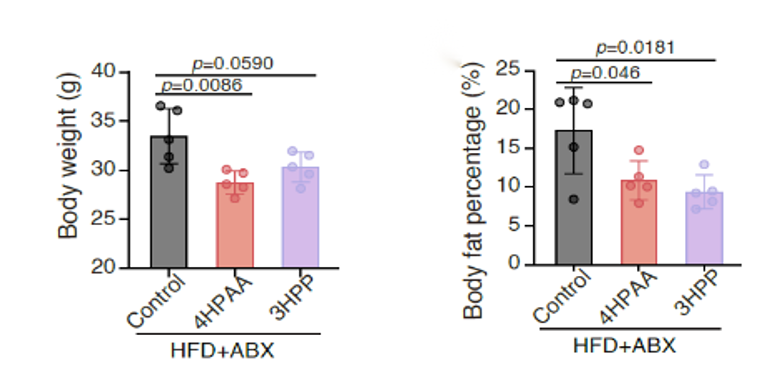
图4. 4HPAA和3HPP可不依赖于肠道菌群发挥作用为进一步研究这些芳香族氨基酸代谢分子预防肥胖产生的机制,研究团队比较分析了长期饲喂4HPAA的小鼠和对照小鼠的肠道组织全转录组。结果显示与对照组相比,饲喂组小鼠肠道黏膜具有较高的适应性免疫和较低的脂质转运和代谢(图5)。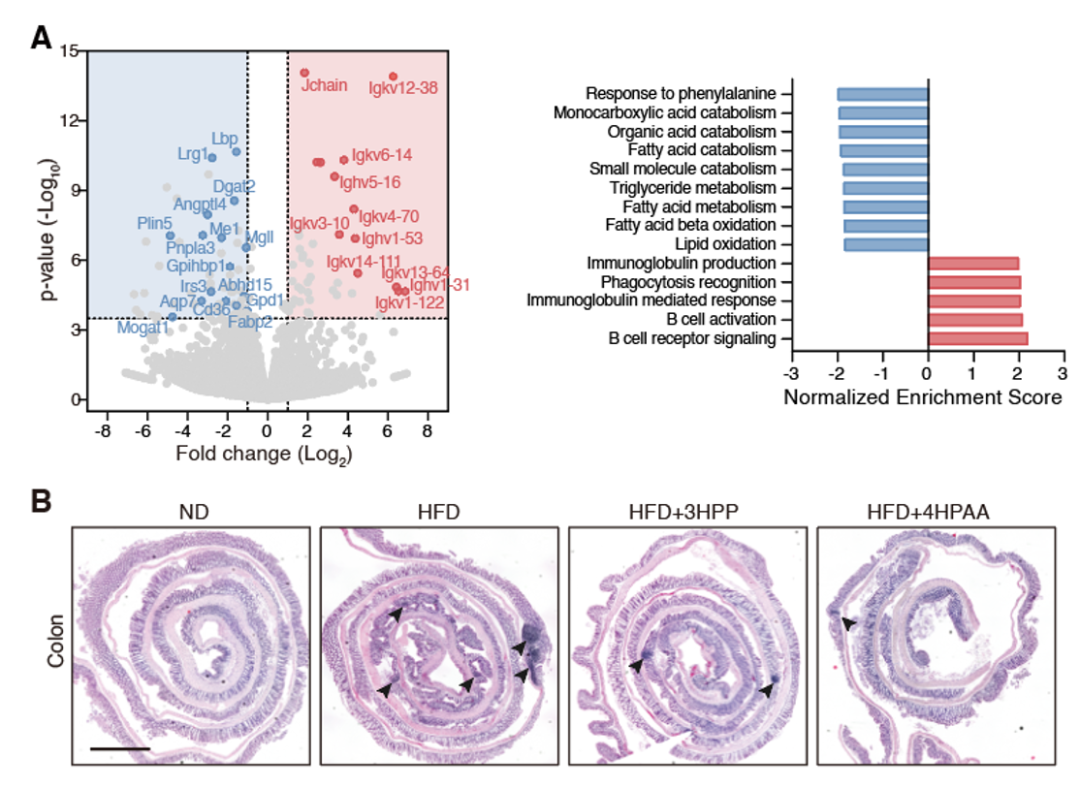
图5. 4HPAA饲喂显著改变了肠道上皮的免疫和脂代谢通路。(A)转录组和通路分析显示4HPAA饲喂的小鼠肠道上皮与对照组相比,免疫和脂代谢通路发生了明显变化。(B)组织学分析显示4HPAA饲喂小鼠的肠道慢性炎症水平相较对照组显著降低。由于免疫和代谢涉及了复杂的网络调控,为了寻找4HPAA影响肠道的早期信号和调控通路,尤其是参与该过程的免疫细胞种类,研究者转而关注小分子饲喂小鼠后更早的时间点。预实验表明,肠道中的B细胞数量大约在16天后开始有所变化,而脂代谢相关基因的表达要在更晚时候才会有所变化。接下来研究者分析了包括B细胞、T细胞、固有淋巴细胞(ILCs)等在内各类免疫细胞组分在不同饲喂组中的差异,并发现在4HPAA饲喂的早期(2周左右),ILC细胞的占比最早发生变化。之后研究者使用了Rag2-/-、Il2rg-/-、Rag2-/-Il2rg-/-等多种免疫缺陷模型小鼠,发现缺失ILCs的小鼠中,4HPAA饲喂干预效果发生了明显变化。相对而言,缺失了成熟T和B细胞的小鼠对4HPAA饲喂的敏感性与野生型小鼠几乎相同(图6)。这些数据表明ILCs在4HPAA预防肥胖的早期信号中起到了重要作用。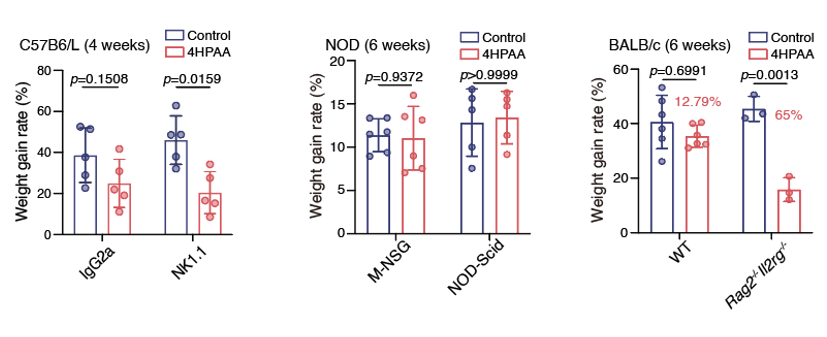
图6. ILCs缺失的小鼠对4HPAA饲喂变得更位敏感西湖大学医学院/生命科学学院/未来产业研究中心陶亮、郑钜圣以及中山大学陈裕明为本文的共同通讯作者。西湖大学副研究员蒋增良(现为浙江大学百人计划研究员)、博士后陈灵君、博士生贺柳晴和李谛音,以及中山大学卓来宝为本文的共同第一作者。特别感谢西湖大学李党生、徐和平、蔡尚和浙江大学的王宇浩等专家对本研究的讨论和帮助。这项研究得到了国家自然科学基金、国家重点研发计划、浙江省“尖兵、领雁”研发计划、浙江省自然科学基金、西湖大学未来产业研究中心、西湖实验室(生命科学和生物医学浙江省实验室)和西湖基因组编辑中心的资助。项目实施还得到了西湖大学生物医学实验技术中心、实验动物中心和高性能计算中心的支持和帮助。西湖大学陶亮课题组(微生物宿主交互实验室)
西湖大学微生物宿主交互实验室(实验室主页:https://tao.lab.westlake.edu.cn/)致力于研究微生物和宿主之间的相互作用方式和内在规律,尤其是从分子、生化、细胞、遗传、病理、代谢等多角度研究细菌及其各类因子对宿主的影响及作用机制。近5年来,成果以通讯报道发表在Cell、Nat Microbiol、Nat Metab、Nat Electron、Nat Commun、Cell Res、Cell Discov、PLOS Pathog、mLife等期刊。实验室长期招收博士后、博士生和科研助理,方向包括且不限于微生物学、免疫学、生物信息学和人工智能、细胞生物学、化学生物学等,诚邀各方青年才俊加入、携手共同成长!
(联系方式:taoliang@westlake.edu.cn)
西湖大学郑钜圣课题组(精准营养与计算医学实验室)
精准营养与计算医学实验室(主页:http://zheng.lab.westlake.edu.cn/)由郑钜圣研究员担任PI,致力于运用人体和人群生物大数据,结合基因组、代谢组、微生物组和蛋白质组等技术手段,在人群层面探索发现人类疾病的全新干预靶点。近5年来,已经在营养微生物组、代谢以及衰老领域取得多项原创性研究发现,成果发表于Nature Metabolism、Cell Genomics、Nature Communications、Gut等杂志。欢迎有志于精准营养或者计算医学等多学科交叉研究的朋友加盟。
(联系方式:zhengjusheng@westlake.edu.cn)

























