
医学院 新闻动态
2025 年 10 月 1 日,西湖大学医学院董晨教授团队应邀在 Nature Reviews Immunology 在线发表了题为 “Regulators of CD8⁺ T cell exhaustion” 的综述文章。该文章系统总结了调控 CD8⁺ T 细胞耗竭的细胞外与细胞内关键因子,为深入理解疾病环境中 CD8⁺ T 细胞耗竭的发生机制及开发相应免疫治疗策略提供了重要参考。
原文链接:
https://www.nature.com/articles/s41577-025-01221-x

在慢性感染和肿瘤等疾病条件下,持续的抗原刺激可诱导 CD8⁺ T 细胞分化为耗竭型 T 细胞(Tex),这是导致临床免疫疗法效果受限的重要原因。其典型特征包括增殖能力与效应功能的逐步丧失,以及抑制性受体的持续高表达。T 细胞耗竭的形成主要由持续的 TCR 信号驱动,同时受到共刺激/共抑制分子信号及细胞外微环境因素(如细胞因子、代谢物、神经因子等)的共同调控。这些外源性信号通过关键的细胞内调控因子(转录因子和表观调控因子),重塑 T 细胞的转录组、表观基因组和代谢状态,使其逐渐进入耗竭状态。揭示这些调控因子在不同耗竭型 T 细胞亚群的命运决定与功能分化中的作用,对于靶向这些因子开发新型抗肿瘤及抗慢性感染免疫治疗策略具有重要意义。
T 细胞耗竭的分化路径
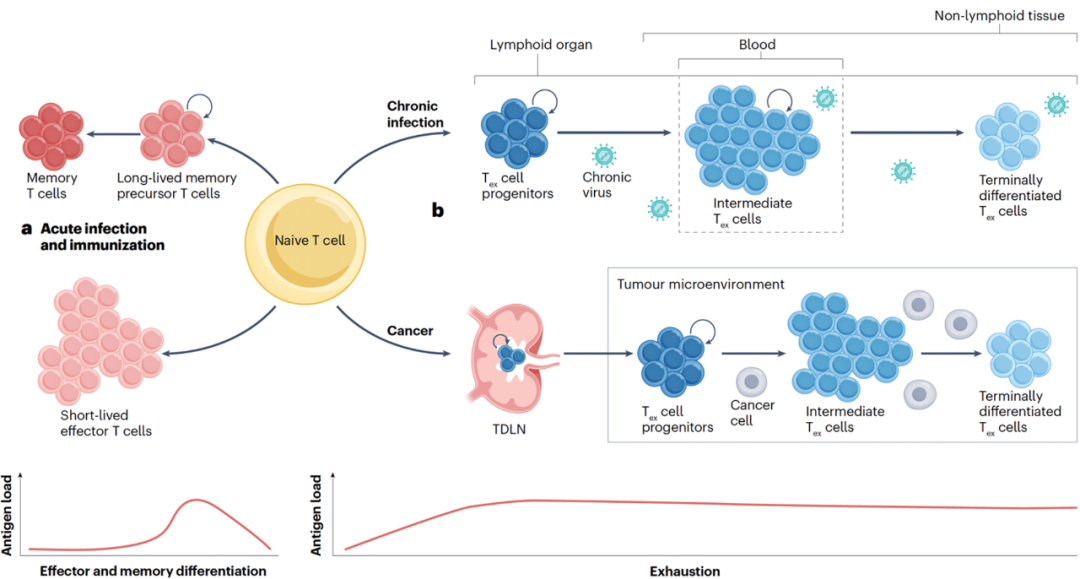
CD8⁺ T 细胞的耗竭过程呈现出分阶段分化特征,各阶段具有不同的功能和表型。在早期阶段,耗竭性 T 细胞仍保留较高的效应功能和增殖能力,并包含记忆功能充足的干细胞样 Tex 细胞亚群。相比之下,晚期 Tex 细胞表现出显著的功能和增殖障碍,记忆潜能受损,持续高表达多种抑制性受体,并进入不可逆的终末分化和功能衰竭状态。除 CD8⁺ T 细胞外,CD4⁺ T 细胞在慢性抗原刺激(如慢性感染、肿瘤及自身免疫)条件下也会出现耗竭现象,表现出与 CD8⁺ Tex 细胞相似的核心特征,同时也具有部分独特性。
干细胞样 Tex 细胞亚群是维持 Tex 细胞持续扩增和免疫反应的关键,并且是免疫检查点阻断疗法(如抗 PD-1/PD-L1)的主要应答者。它们不断分化为效应功能更强的中间 Tex 细胞亚群,发挥抗病毒和抗肿瘤功能。肿瘤研究进一步表明,CD8⁺ T 细胞分化始于肿瘤引流淋巴结中的激活与早期耗竭,主要由干细胞样 Tex 细胞亚群组成,并持续被招募至肿瘤微环境,进一步分化为具有细胞毒活性的 Tex 细胞,最终逐步发展为终末耗竭状态。
细胞外的关键调控因子
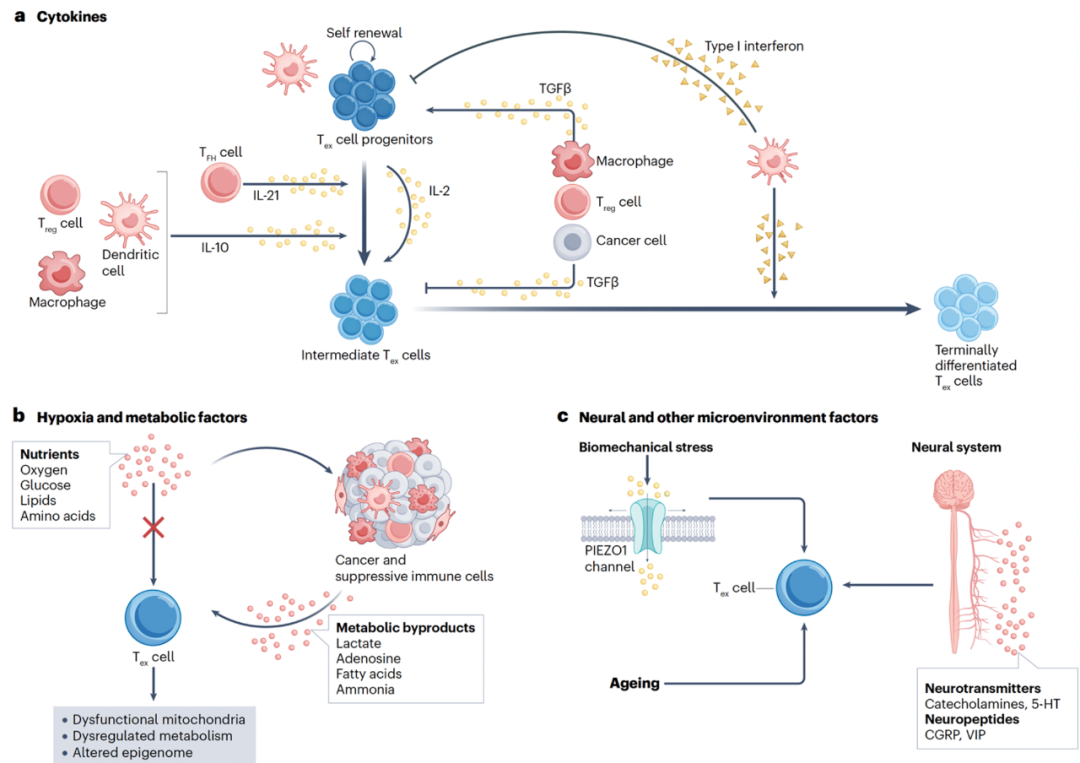
持续的抗原刺激和 T 细胞受体(TCR)信号是驱动 T 细胞耗竭的核心因素,决定了耗竭的进程及其可逆性。在癌症中,只有肿瘤反应性 CD8⁺ T 细胞通常会发展为耗竭表型,而非肿瘤反应性 CD8⁺ T 细胞则保持功能完好的记忆型状态。此外,抗原水平和 TCR 信号强度调控不同 Tex 细胞亚群的分化;抗原递呈细胞(如树突状细胞)在维持干细胞样 Tex 亚群的自我更新与分化中发挥关键作用。
共刺激与共抑制受体在 T 细胞耗竭过程中同样至关重要。阻断 PD-1、CTLA-4 等受体在肿瘤治疗中取得良好疗效。PD-1 持续高表达通过与其配体 PD-L1/PD-L2 结合,抑制 TCR、CD28、IL-2 及 mTOR 信号通路,从而促进 T 细胞耗竭。PD-1 信号阻断可通过诱导干细胞样 Tex 亚群的扩增和分化来增强 Tex 细胞的抗病毒和抗肿瘤功能。不同免疫检查点联合阻断(如 PD-1 + CTLA-4、PD-1 + LAG3)显示出协同治疗效果。共刺激受体(如 CD28、4-1BB)则在维持 Tex 细胞增殖和功能中发挥重要作用。
细胞因子在 Tex 亚群的分化与功能调控中发挥关键作用。TGFβ 是维持干细胞样 Tex 亚群并阻止其终末分化的核心因子,而 IL-2、IL-10、IL-21 则促进干细胞样 Tex 亚群向效应型 Tex 亚群分化,并增强其效应功能。细胞因子的调控具有多面性:例如,TGFβ 在维持 Tex 细胞干性同时,可抑制其增殖与效应功能;而持续的 IL-2 和 IL-12 则可推动终末耗竭分化。临床上,细胞因子疗法(如 IL-2)显示出显著潜力,并与免疫检查点阻断(如 PD-1 阻断联合 IL-2)产生协同性治疗效果。
代谢和微环境因素在 CD8⁺ T 细胞耗竭中起着重要作用。在感染和肿瘤微环境中,缺氧通过 HIF1α 等细胞内因子调控耗竭进程,诱导 CD39 和 CD73 表达,升高腺苷水平,损害线粒体功能及代谢稳态,并促进抑制性免疫细胞的分化与聚集。有限的营养物质(如氧气、葡萄糖、脂质和氨基酸)在疾病微环境中存在竞争,进一步限制 CD8⁺ T 细胞功能;乳酸、腺苷、氨及部分脂肪酸等代谢产物也会干扰 T 细胞代谢,推动耗竭。此外,神经递质、神经肽、衰老及实体瘤中的生物机械应力等因素亦可调控 CD8⁺ T 细胞耗竭。
环境细胞调控同样重要。肿瘤微环境中的 Treg 细胞通过多种机制抑制 T 细胞增殖和功能,并通过竞争 IL-2 削弱 PD-1 阻断疗法效果。肿瘤中三级淋巴结构可促进 CD8⁺ T 细胞自我更新和功能维持。同时,CD8⁺ 与 CD4⁺ T 辅助细胞的相互作用在免疫治疗中也发挥关键作用。
细胞内的关键调控因子
细胞外调控因子通过激活细胞内转录因子和表观遗传调控因子,驱动 T 细胞耗竭相关的独特转录与表观遗传程序。持续的 TCR 信号可导致过量的NFAT结合耗竭相关基因位点,驱动耗竭命运形成。同时,TOX 和 NR4A 在耗竭过程中持续高表达,与 NFAT 协同作用,抑制效应功能与增殖能力,并维持抑制性受体的高表达,从而建立和维持耗竭特异性转录及表观组。
TCF1–BCL6–BLIMP1 转录因子网络在调控耗竭型 T 细胞干细胞样亚群的维持及终末效应型亚群分化中发挥关键作用。TCF1 和 BCL6 在干细胞样 Tex 细胞亚群中高表达,以非冗余方式促进前体的发育与维持。TCF1 支持干细胞样 Tex 细胞的自我更新与长期存在;BCL6(受 TGFβ–SMAD 通路激活、IL-2–BLIMP1 通路抑制)通过抑制终末效应型分化、细胞毒性和增殖,保持干细胞样特性。BLIMP1 拮抗 TCF1 和 BCL6 的功能,抑制干细胞样 Tex 细胞亚群的维持,促进终末效应亚群分化。STAT 信号通路可被多种细胞因子激活(如 IL-2 激活 STAT5,IL-10/IL-21 激活 STAT3),促进 Tex 细胞的效应分化、增殖及效应功能,从而增强抗病毒与抗肿瘤能力。

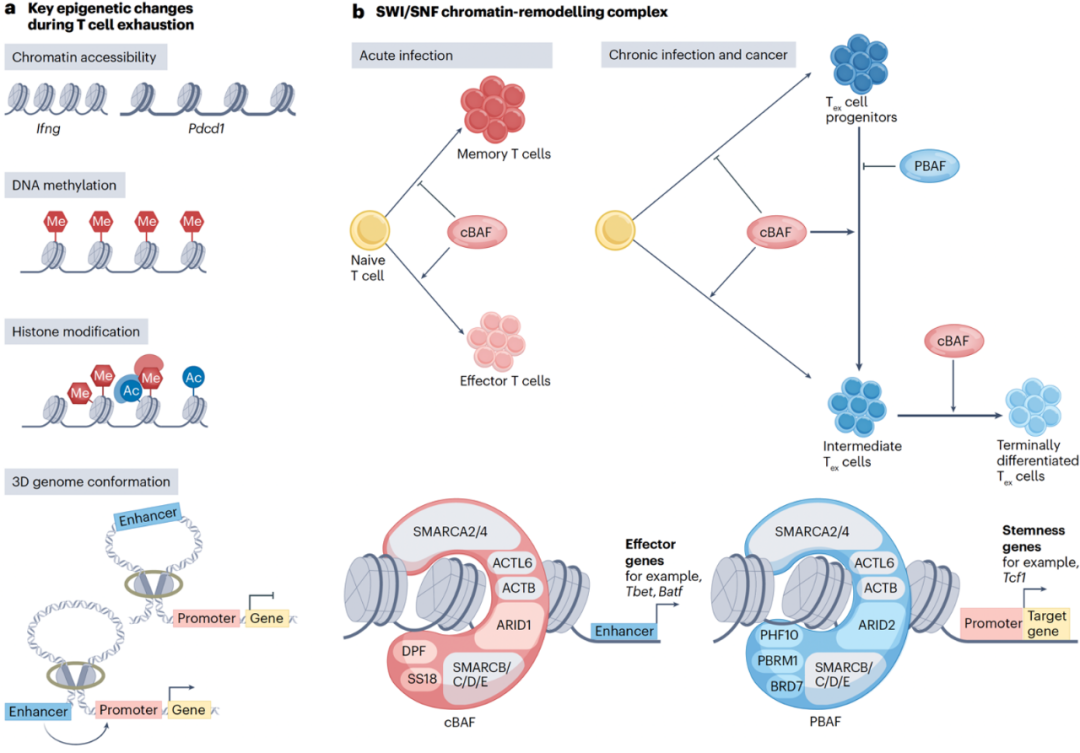
T 细胞耗竭还伴随表观基因组的重塑,包括染色质可及性变化(如 Ifng 位点可及性下降、Pdcd1 位点开放性增加)、DNA 甲基化、组蛋白修饰及三维基因组构象改变等。这些耗竭特异性表观印记限制了 T 细胞耗竭的逆转与免疫治疗效果。染色质重塑复合体 cBAF在 Tex 细胞中驱动效应样及终末分化,同时抑制干细胞样 Tex 细胞的维持;相对地,PBAF 复合体则维持干细胞样 Tex 细胞,抑制效应型 Tex 分化,并削弱抗病毒与抗肿瘤功能。
综上所述,该综述文章系统总结了调控 CD8⁺ T 细胞耗竭的关键因子,深入解析了其耗竭机制,并为靶向这些关键调控因子开发新型免疫疗法提供了重要的参考与指导。
西湖大学医学院董晨教授为本文通讯作者,清华大学基础医学院已毕业博士生、现任美国斯坦福大学医学院博士后孙勤利为本文第一作者。本研究得到中国国家自然科学基金、国家重点研发计划、中国医学科学院医学创新基金及新基石科学基金会等的支持。

















