
医学院 新闻动态

“你最好不要抗拒衰老,不然你就死定了。”
如果脱口秀要吐槽一下衰老,恐怕得来上这么一句。衰老不可避免,如何老去才是一个问题。有的人先白了头,有的人先长了斑,有的人先变了心。
而在诸多抗衰老的策略中,饮食常被提及。
北京时间10月24日晚11点,西湖大学郭天南团队在《细胞》杂志发表研究,通过追踪小鼠“一生饮食日记”以及人类饮食调研,揭开了蛋白质摄入与衰老潜在的秘密——限制蛋白质摄入可能具有延缓衰老的潜力,并根据相关的小鼠实验推测,中年或是最佳窗口期。
新观点的背后,是郭天南团队长期从事的蛋白质组学研究。作为一门新兴的学科,蛋白质组学提供了研究复杂生命活动的新视角。

论文地址:
https://www.cell.com/cell/fulltext/S0092-8674(25)01133-X
01 蛋白质交响
作为中国古典文化的巅峰绝响,《红楼梦》透露出了古代顶级阶层的饮食观念。哪怕在钟鸣鼎食的贾府,生病调养首选饮食方案,是少吃和清淡,比如袭人病时,只吃些米汤静养。
这与当今的一些饮食理念相呼应。为延长寿命或改善健康,人们提出了多种饮食干预措施。例如,生酮饮食可用于减重或治疗儿童癫痫,但其严格限制碳水化合物的要求不仅影响日常饮食快乐,还可能引发疲劳、头痛等适应期症状,其长期效果和安全性仍有待验证。
相比之下,蛋白质限制作为一种饮食干预措施,在减重和延缓衰老方面显示出潜力。一些流行病学的研究表明,适度减少蛋白质摄入可以改善代谢健康,包括降低葡萄糖和胰岛素水平、增强胰岛素敏感性以及促进脂肪减少。
说通俗一点,肉蛋奶虽好,切莫贪吃。
不过,蛋白质限制带来的更深层的生物学影响,并不十分清晰,它对不同器官的衰老产生了哪些影响?这种饮食方式在不同性别、不同衰老阶段又会产生何种差异?
这也是郭天南团队这次研究的出发点。
刚才我们说的“蛋白质”是从营养角度,而接下来要说的“蛋白质”,是构成生命活动的最基本单元。19世纪末,中国曾把蛋白质翻译成“朊”,以便与“脂”“糖”“盐”并列。英文protein来自于希腊语proteios,意为“首要的”或“第一位的”,“朊”中的“元”也有同义。
而生命的巧思在于,只有20种基本的氨基酸,通过彼此排列组合、折叠变幻形成了千姿百态的蛋白质。可以说,蛋白质是生命活动的主要执行者。如果基因是曲谱,那蛋白质就是根据曲谱演奏出来的复杂旋律。
想象一下,一个生命体内的所有细胞几乎拥有相同的遗传基因,却能演化出形态各异的细胞类型;更神奇的是,这些细胞还在不断变化——如蛹化蝶、蝌蚪成蛙。而在这一切变化的背后,正是无数蛋白质在默默“执行任务”。
“就算一滴眼泪里,也有数千种蛋白质。”郭天南说。
蛋白质组学正是在这一视角下应运而生,关注一个细胞、组织或生物体在特定时间、特定条件下所表达的全部蛋白质集合。蛋白质组会随着时间、环境、生理状态等发生变化。通过研究蛋白质组的数据,我们得以窥见生命活动的一些秘密。
所以,衰老的旋律,是否也在蛋白质的奏响里?
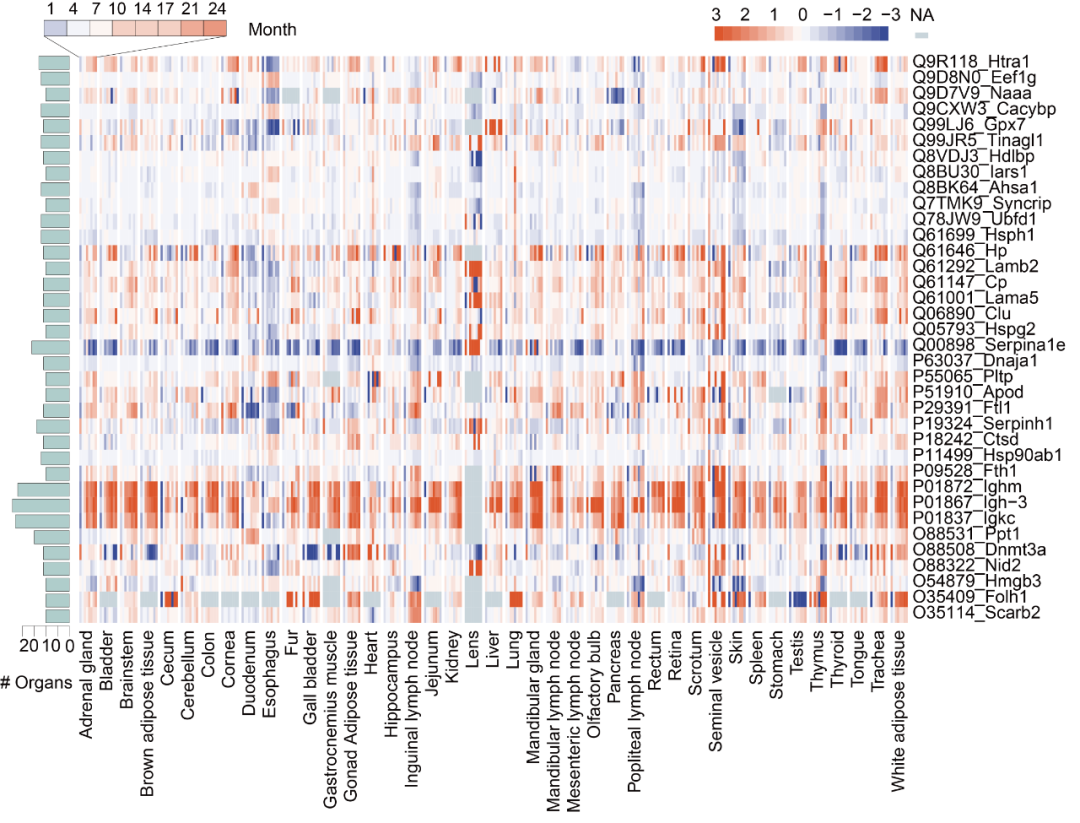
衰老的多器官"分子地图"追踪了36个关键蛋白质在至少9个器官中随年龄显著变化的表达模式。底部英文对应小鼠器官,右侧英文对应蛋白质,颜色代表蛋白的表达量。
02 三种鼠生
为了系统探索衰老与蛋白质摄入的关系,郭天南团队设计了复杂而漫长的小鼠实验,完成了长达两年的整个小鼠生命周期的追踪。
这项研究的第一作者兼主要推动者陆恬,为了完成这个项目,成为了西湖大学"迟迟不愿离校的博士毕业生" 。

从2019年开始,陆恬开始了这个饮食与衰老关系的课题,研究小鼠不同饮食习惯如何对它们的衰老产生影响。为了这个课题,她博士毕业后又在学校待了一年多。
接下来,我们切换下叙事方式,如果您是实验小鼠,在这场实验中,您有三种鼠生模式可以选择——
“豪门组”:吃40%蛋白质的“硬菜”,相当奢靡。
“平民组”:吃20.7%蛋白质的“家常饭”,过着平凡的鼠生。
“清流组”:只吃5%蛋白质的“轻食餐”,主打一个佛系。
选好了吗?您尊贵的鼠生不能后悔。
当然,设定的饮食体验不需要一辈子,您可以选择在鼠生的不同阶段来体验设定的饮食模式——青年、中年、老年。以小鼠两年寿命为基准,这三个阶段分别对应7-10个月、12-15个月和20-23个月,换算成人类年龄,大约是32-38岁、43-49岁和60-67岁。比如,如果您选了“豪门组”,接下来您还可以选择体验时间,可以是年少的锦衣玉食,可以是中年的大快朵颐,也可以是晚年的珍馐美馔。
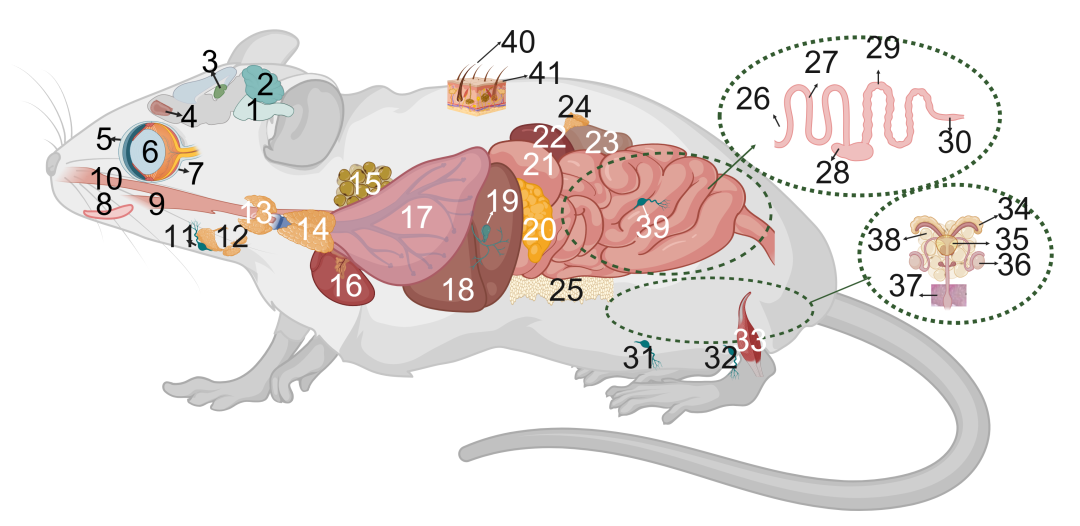
1 脑干 2小脑 3海马 4嗅球 5角膜 6晶状体 7视网膜 8舌 9食管 10气管 11下颌淋巴结 12下颌腺 13甲状腺 14胸腺 15棕色脂肪组织 16心脏 17肺 18肝脏 19胆囊 20胰腺 21胃 22脾脏 23肾脏 24肾上腺 25白色脂肪组织 26十二指肠 27空肠 28盲肠 29结肠 30直肠 31腹股沟淋巴结 32腘窝淋巴结 33腓肠肌 34 精囊 35膀胱 36睾丸 37阴囊 38性腺脂肪组织 39肠系膜淋巴结 40毛发 41皮肤
在鼠生的尽头,41个器官将被制备成样本,送入质谱仪进行蛋白质组测定,完成为科学的壮烈献身。最终的数据结果,如同鼠鼠一生的总结报告。研究团队还以自然衰老小鼠为对象,设置了8个采样时间点,以描绘生命全程的蛋白质变化;而饮食干预组的小鼠则分别在干预3个月后取材。若有幸,部分小鼠或许能在实验室安然养老。
如此设计,是为了监测不同蛋白质摄入对不同年龄阶段,以及不同器官的衰老影响。如郭天南介绍,这是一种时间和空间结合的思路——时空蛋白质组。
最终,郭天南团队建立了包含13042种蛋白质的高质量小鼠谱图库。基于此,他们在2565个组织样本中定量分析了超过11000种蛋白质,首次绘制出覆盖全身41个器官的衰老与饮食干预的蛋白质组图谱。
这是一个如同漫天繁星一样的“蛋白质宇宙”。和抬头仰望星空不同的是,接下来我们需要低下头,在生命的宇宙里,在数据中,寻找蛛丝马迹。
03 体检报告
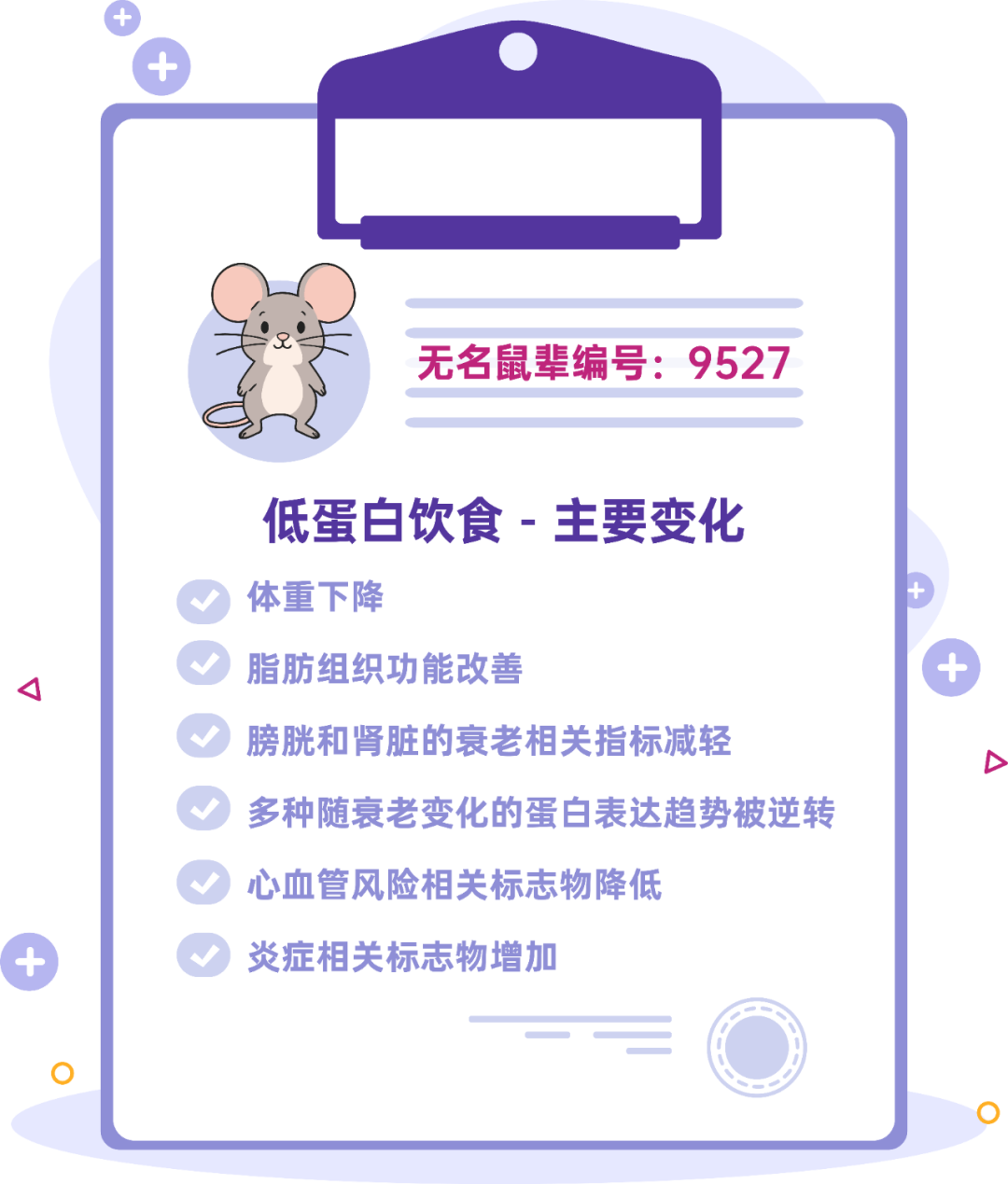
先看体重。“清流组”相比“豪门组”体重下降,这个很符合预期。但更有意思的是,“清流组”小鼠脂肪组织正常看上去也更健康,“豪门组”容易出现的白色脂肪细胞肥大和棕色脂肪组织形态受损,在“清流组”那都得到了改善,甚至棕色脂肪的活性还得到了增强。棕色脂肪可以产热,被认为是更好的脂肪,而且往往越年轻越多。
“清流组”还出现了其他显微镜可见的组织改变,比如肾脏,与“豪门组”相比,“清流组”肾脏中衰老细胞的积累显著减少。
不过,也需要特别提醒“清流组”,低蛋白饮食可能导致脂肪肝和肝细胞衰老,贫穷的日子里,小心肝啊。
好,接下来是重点——蛋白质组数据分析,规律也许隐藏在数据深处。
随着小鼠年龄的增长,36个蛋白质在9个以上器官中持续改变,且这些变化早在小鼠1月龄就已出现,衰老比你想象的要来得早。对比之下,在衰老过程中变少的22个蛋白质可在“清流组”中增多,可以理解为衰老相关的“蛋白质指标”改变了。
这22个蛋白质的逆转,呈现出最直观的数据变化。透过这些数据变化,陆恬、谢玉婷等西湖大学博士生与合作伙伴们深入挖掘,逐步推演出背后更复杂的生物学机理,一步步揭开蛋白质限制与衰老之间的关联。
中年雌性小鼠的膀胱组织透露出一个重要线索:低蛋白饮食组中,两种负责DNA甲基化的关键酶(Dnmt3a和Dnmt1)的含量明显升高。尤其值得注意的是,这两种酶恰恰会在衰老过程中表达下降,但低蛋白饮食逆转了这一趋势。这意味着,蛋白质限制很可能通过调控DNA甲基化影响泌尿系统。DNA甲基化,你可以理解成基因序列上的一个“化学标签”,基因序列本身没变的情况下,但小小标签可以影响哪些基因该读、哪些该沉默,如同特定基因的开关,也和细胞增殖和癌症发生有密切关系。
实验团队于是更进一步探寻。
果不其然,研究团队结合一种DNA甲基化测序方法,发现衰老会导致小鼠膀胱组织样本内的多个肿瘤抑制基因的多个启动子高甲基化,有趣的是,高蛋白饮食亦有类似效应。其中,衰老与高蛋白饮食共有的13个癌症DNA甲基化生物标志物,均呈高甲基化状态,提示二者都可能增加潜在的癌症风险。
换句话说,高蛋白饮食展现出类似于衰老的甲基化模式。相反,研究团队还发现低蛋白饮食可减少肾脏衰老,并降低膀胱预测的生物学年龄。这些都显示蛋白质限制具有潜在的保护效应。
也难怪坊间有句地狱笑话,人的一生大概要吃掉十头大象的重量,谁先吃完谁先走。在察觉到和癌症发生的潜在关联之后,研究团队还发现了低蛋白饮食可能影响了能量代谢。
他们发现,作为寿命调控的重要能量代谢通路,AMPK的6个亚基在衰老过程中改变,而低蛋白饮食能够逆转这一变化,尤其在棕色脂肪组织和胰腺中最为显著。AMPK中文名为腺苷酸活化蛋白激酶,是细胞的“能量总开关”,能量不足时开启可以促分解代谢,它的激活也常与提高胰岛素敏感性相关。大名鼎鼎的口服降糖药二甲双胍,正是AMPK间接激活剂,也是抗衰老研究中的“明星分子”。
研究团队使用更多的检测手段进一步验证,低蛋白饮食或许是通过调控AMPK及其靶蛋白的磷酸化,以及一些与脂肪功能密切相关的蛋白表达,提升脂肪组织功能,从而改善脂质代谢与胰岛素敏感性。
低蛋白饮食的影响,还呈现出器官和年龄的差异性,中年雄鼠最为敏感,表现出最显著的进食量、体重及脂肪功能改善。村上春树说:“我以为人是慢慢变老的,其实不是,人是一瞬间变老的。”
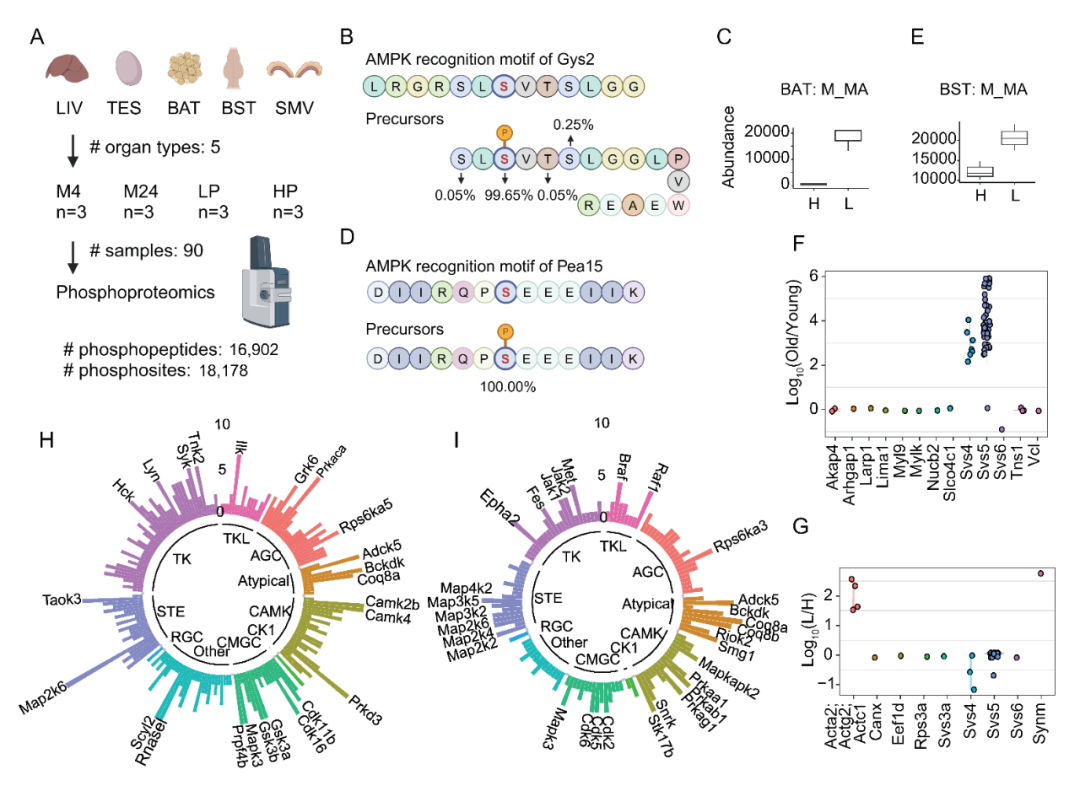
多器官磷酸化蛋白质组学分析
04 给人的启示
小鼠的蛋白质组学数据当然不能完全等同于人类——毕竟两者差异巨大。但这些数据依然能为我们理解人类生命提供启发。尤其是通过血液检测,我们能够在人和小鼠之间建立可对比的联系。
为了验证蛋白质限制和人类健康的相关性,郭天南团队与郑钜圣团队合作,分析了272名26至88岁个体在2015年和2018年的544份配对血浆样本和问卷数据。结果显示,低蛋白饮食与胰岛素和糖化血红蛋白(HbA1c)水平降低相关,提示糖代谢改善;同时谷丙转氨酶(GPT)水平也下降。这些变化共同指向整体代谢健康的提升。
研究发现,低蛋白质摄入条件下,人血浆中的IGF1(胰岛素样生长因子1)和GHR(生长激素受体)水平较低,IGF1信号通路受到调控。这一结果与小鼠血浆中观察到的情况一致。IGF1信号通路被认为是调节生长与衰老的关键通路,已有多项研究表明,抑制该通路可延长多种模式生物的寿命。
此外,蛋白质摄入量与低密度脂蛋白胆固醇(动脉粥样硬化的主要“元凶”)和收缩压(高压)呈正相关,表明适度蛋白质限制可降低心血管风险。然而,最显著的差异表达蛋白PTX3的上调和SELENOP的下调提示炎症反应增加和抗氧化能力下降,暗示极端低蛋白摄入可能存在副作用,提示存在最佳蛋白质摄入区间。
We are what we eat,人如其食。在食物链顶端的人类,似乎拥有极大的食物选择权,但选择吃什么,最终会影响我们。
郭天南教授表示,这项发现为“饮食-衰老”领域增添了新维度,提示“吃什么、何时吃”可能影响多器官如何老去。未来,郭天南团队计划进一步研发高内涵时空蛋白质组技术,对衰老、肿瘤等重大健康问题展开更深入研究,并着手构建虚拟细胞模型,以期为生命活动、疾病演变和精准治疗提供更准确的预测与干预。

前排左起:王瑛睿(副研究员)、谢玉婷(博士生)
后排左起:张寓琪(博士生)、朱怡(研究员)、郭天南(教授)、蔡雪(博士后)、聂宗祥(科研助理)
致谢
本研究由西湖大学医学院毕业博士生陆恬(现为哈佛大学博士后),博士生谢玉婷担任共同第一作者,西湖大学医学院郭天南教授,西湖实验室朱怡研究员为文章共同通讯作者。研究工作得到了多位合作者的大力支持,包括西湖实验室王瑛睿副研究员,西湖大学医学院郑钜圣教授、蔡雪博士后、聂宗祥科研助理与博士生张寓琪、(原)西湖实验室助理研究员苟望龙博士,浙江大学医学院附属第二医院内分泌代谢科主任医师单鹏飞与毕业博士生林喜铃,中国疾病预防控制中心营养与健康所王惠君研究员与苏畅研究员,浙江省肿瘤医院张宏教授,浙江大学核医学与分子影像研究所王菁研究员,浙江大学医学院附属第二医院钟燕医师,以及西湖大学医学院附属杭州市第一人民医院病理科项晶晶副主任医师与来泽寅医师。项目获得了西湖大学未来产业研究中心、西湖实验室、国家自然科学基金,国家重点研发计划,国家科技重大专项,浙江省“尖兵”“领雁”研发攻关计划的资助。项目实施过程中得到了西湖教育基金会的大力支持。
蛋白质组复杂科学实验室
西湖大学蛋白质组复杂科学实验室(Guomics)是依托西湖大学、西湖实验室(生命科学和生物医学浙江省实验室)和医学蛋白质组全国重点实验室成立的一个多学科交叉的AI蛋白质组学实验室。实验室长期从事蛋白质组学相关研究,联合人工智能,构建虚拟细胞,解析生物过程的原理,助力疾病诊疗。团队诚邀有志于虚拟细胞研究的优秀本科生、研究生及博士后研究人员加盟!实验室官网:guomics.com

















