
医学院 新闻动态
东汉建安五年,中国历史上发生了一场著名的“以少胜多”的战役。
袁绍率领十万大军压境,曹操兵力不足两万,因粮草短缺、情报闭塞陷入绝境。直到袁绍麾下谋士许攸深夜投曹,带来“乌巢存粮、守军薄弱”的关键情报,曹操亲率五千步骑兵伪装袁军,趁夜焚毁袁军粮草,瞬间扭转了战局。
这是官渡之战,这场战役告诉我们,战争的胜负,从来不止是兵力多寡的较量,有时候,能突破封锁、精准传递关键信息的“情报员”,才是破局的核心。
在人体这个“微观战场”上,免疫系统与肿瘤的“持久战”每天都在激烈上演,同样,免疫系统也有出色的“情报员”——抗原递呈细胞,它们肩负着“穿越敌阵、收集敌情、通知援军”的重任,这其中,有一位王牌——cDC1细胞,它激活CD8 T细胞的能力最强。面对肿瘤微环境的“重重封锁”,它们是如何突出重围、传递信息、激活T细胞的?
2025年11月13日,西湖大学董晨课题组在Science杂志发表最新研究成果,揭示了当cDC1遇到坏死肿瘤细胞时,如何一步步成为有效连接适应性免疫应答、激活杀伤性T细胞的桥梁。这项工作为理解树突状细胞功能调控机制提供了全新的视角,同时为开发更有效的免疫治疗策略提供了新的线索。
论文截图
论文链接:
https://www.science.org/doi/10.1126/science.ady5362
免疫战场上的核心角色
在这场免疫系统与肿瘤的“攻防战”中,我们先来厘清几个核心角色和场景——
cDC1是谁——免疫系统的“情报员”
抗原递呈细胞是指能够摄取、加工处理抗原,并将处理过的抗原呈递给T细胞的一类免疫细胞,它们是免疫系统的“情报员”,主要负责在体内巡逻,寻找肿瘤细胞以及细菌、病毒等病原体相关物质。
它们会捕捉“敌人的特征信息”(异己成分),把信息加工后展示在自己表面,再传递给免疫系统的“作战部队”(CD8 T细胞),使之“训练后”能够精准找到并消灭敌人。“专职”的抗原递呈细胞有单核-巨噬细胞、树突状细胞和B淋巴细胞,其中,树突状细胞是“精锐部队”。cDC1细胞,本次研究的主角,就是树突状细胞中的一种,是体内交叉递呈能力最强的细胞,属于“精锐部队”中的“王牌”。
CD8 T细胞——免疫系统的“作战部队”
CD8 T细胞是免疫系统的“作战部队”,能特异性杀伤肿瘤细胞和被病毒感染的异常细胞。目前热门的肿瘤免疫疗法,比如PD-1/PD-L1抑制剂、CAR-T细胞疗法,核心都是围绕激活CD8 T 细胞的战斗力展开。但在机体内,CD8 T细胞的常规激活需要抗原递呈细胞传递的“情报”,接收到“情报”它们才能进入状态,明确攻击目标。
何为“交叉递呈”——特殊的“情报传递“方式
通常情况下,“情报员”只能传递内部发现的敌人信息(比如被病毒感染后,细胞内产生的病毒蛋白)。但肿瘤细胞不是病毒,是cDC1的“外部敌人”,不会进入抗原递呈细胞内部,这时,就需要一种特殊的“情报传递方式”——交叉递呈,就是吞噬外部抗原后的一种递呈方式。例如,cDC1细胞会先“吞噬”肿瘤细胞的碎片,在细胞内把碎片加工和组装成合适的成分,再展示在细胞膜表面,进而激活CD8T细胞。
最后,这场“免疫之战”在哪儿发生?肿瘤微环境中。
肿瘤从来不是孤立存在的,而是一个复杂的生态系统,这就是肿瘤微环境,里面除了肿瘤细胞,还有各种免疫细胞、非免疫细胞,以及这些细胞分泌的大量分子。肿瘤微环境到底是释放抑制信号,削弱免疫系统的战斗力,还是会暴露踪迹,给免疫系统提供攻击线索?cDC1细胞如何在这个复杂的环境中完成自己的任务,哪些分子事件决定其交叉递呈能力?这是研究团队亟待看清的。
除了肿瘤本身,免疫战争的“战场”还涉及到引流淋巴结,这是离肿瘤最近的“免疫战场中转站”。
在人体的淋巴系统中,淋巴液会从组织间隙中的淋巴管流向特定的淋巴结,当身体某部位发生病变时,病变部位携带抗原物质的细胞,甚至肿瘤细胞等可随着淋巴管首先到达引流淋巴结。在感染的情况下,引流淋巴结会发挥免疫防御功能,淋巴细胞会在淋巴结内被激活。当cDC1细胞在肿瘤微环境中捕捉到肿瘤抗原后,其中部分细胞首先会迁移到引流淋巴结——这里聚集着大量待命的免疫细胞,cDC1细胞会在这里把“敌情”传递给T细胞,让它们做好战斗准备后,再奔赴“肿瘤”战场。
锁定Ms4a7——cDC1的“情报通讯密钥”
搞清楚了这些概念之后,一起来看看研究团队关注的问题——“王牌情报员”cDC1细胞是激活抗癌免疫的关键,但肿瘤微环境又如此复杂,这个树突状细胞是如何在这种“敌强我弱”的环境中,维持交叉递呈能力、顺利传递情报的? 又是谁在调控这个细胞的功能?
研究团队构建了携带绿色荧光蛋白的肿瘤细胞株,只要cDC1细胞吞噬了肿瘤抗原,就会带上绿色荧光,帮助研究人员判断哪些细胞在工作。随后,他们对“工作状态”和“休息状态”的cDC1细胞进行基因测序。结果显示,工作状态的cDC1细胞中,有几十个基因的表达明显上调,包括一个名为Ms4a7的基因。它在未工作的cDC1细胞中几乎“沉默不语”,但在吞噬了肿瘤抗原的cDC1细胞中,又变得活跃起来。
为了确认Ms4a7基因的作用,团队用CRISPR基因编辑技术“敲掉”了cDC1细胞中的Ms4a7基因,结果显示,缺少Ms4a7基因的cDC1细胞,交叉递呈能力大幅下降,好比“情报员”丢失了“密码本”,无法把关键信息有效传递给CD8T细胞。
这一实验明确了Ms4a7基因是维系cDC1细胞交叉递呈功能的关键分子。
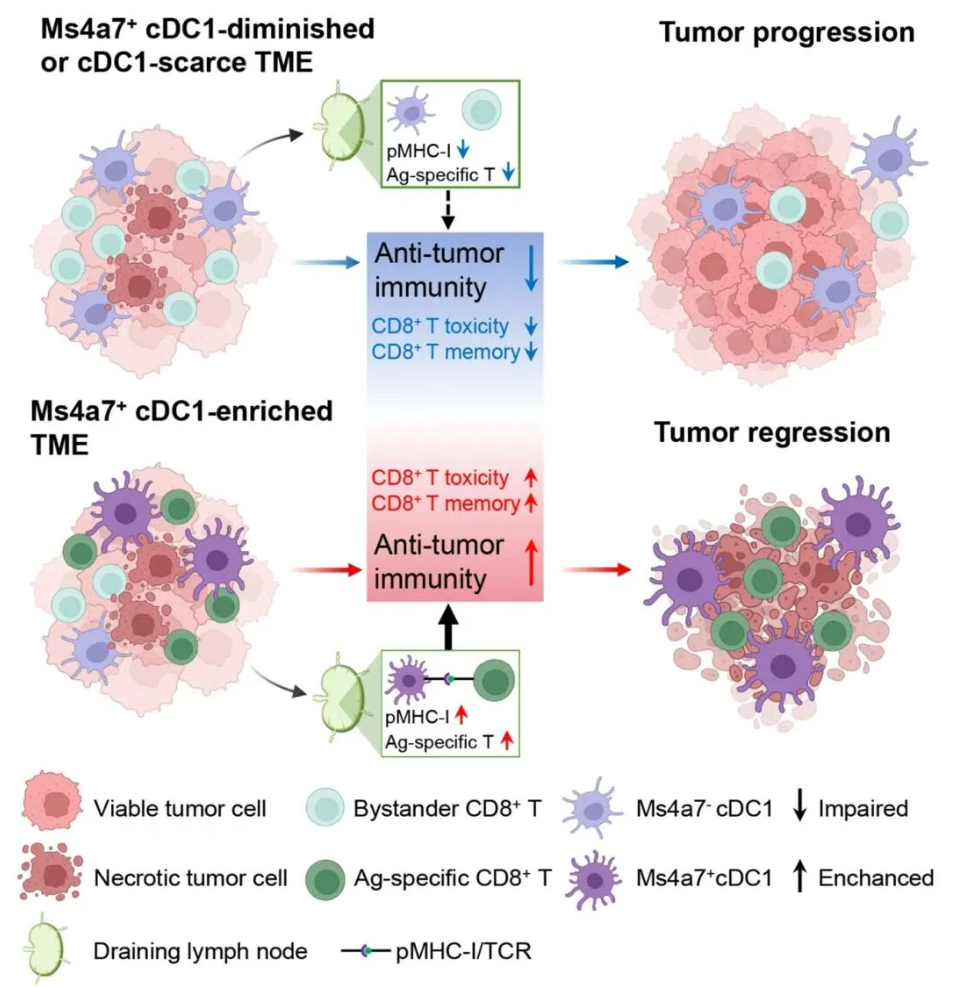
Ms4a7+ cDC1s增强CD8+ T细胞活化和抗肿瘤免疫。肿瘤微环境中Ms4a7+ cDC1s的富集可促进抗原特异性(Ag-specific)CD8+ T细胞的活化和扩增。(注:pMHC-I:肽-主要组织相容性复合体I复合物;TCR:T细胞受体)
系列实验拆解机理——Ms4a7如何助力cDC1“精准传递情报”?
在发现Ms4a7这个分子后,研究团队从体外到体内、从细胞到动物,做了一系列实验,试图还原Ms4a7基因对T细胞抗肿瘤免疫的影响。
体外实验:只影响交叉递呈,不干扰其他功能
研究团队发现,面对外来的肿瘤抗原时,缺少Ms4a7基因的cDC1细胞激活T细胞的能力显著减弱,当面对内源性抗原时,则是没有太大差异。更为关键的是,它不影响cDC1细胞激活其他类型T细胞的能力,说明Ms4a7基因只负责交叉递呈这一专项任务。
小鼠体内实验:Ms4a7基因缺失,肿瘤长得更快
体外实验后,研究团队在小鼠体内继续验证,发现敲除Ms4a7基因的小鼠和cDC1细胞缺陷小鼠体内的肿瘤生长速度明显更快,存活时间更短。为了排除其他细胞的干扰,团队还构建了骨髓嵌合模型,证明了Ms4a7基因的确是通过调控cDC1细胞的功能来影响T细胞的抗肿瘤免疫反应,而不是通过其他细胞发挥作用。
肿瘤再移植实验:影响记忆T细胞
免疫系统的“厉害之处”不仅在当下,还在于形成“记忆”,比如得过一次感冒后,身体会产生记忆T细胞,下次再遇到同款病毒就能快速消灭抗原。于是,团队做了肿瘤再移植实验,发现敲除Ms4a7基因的小鼠和缺失了cDC1细胞的小鼠,部分会再次长出肿瘤,但是野生型小鼠能完全阻止肿瘤再次生长,这说明了缺失了Ms4a7基因,不仅会削弱初始T细胞应答,也会损害记忆T细胞相关的抗肿瘤能力。
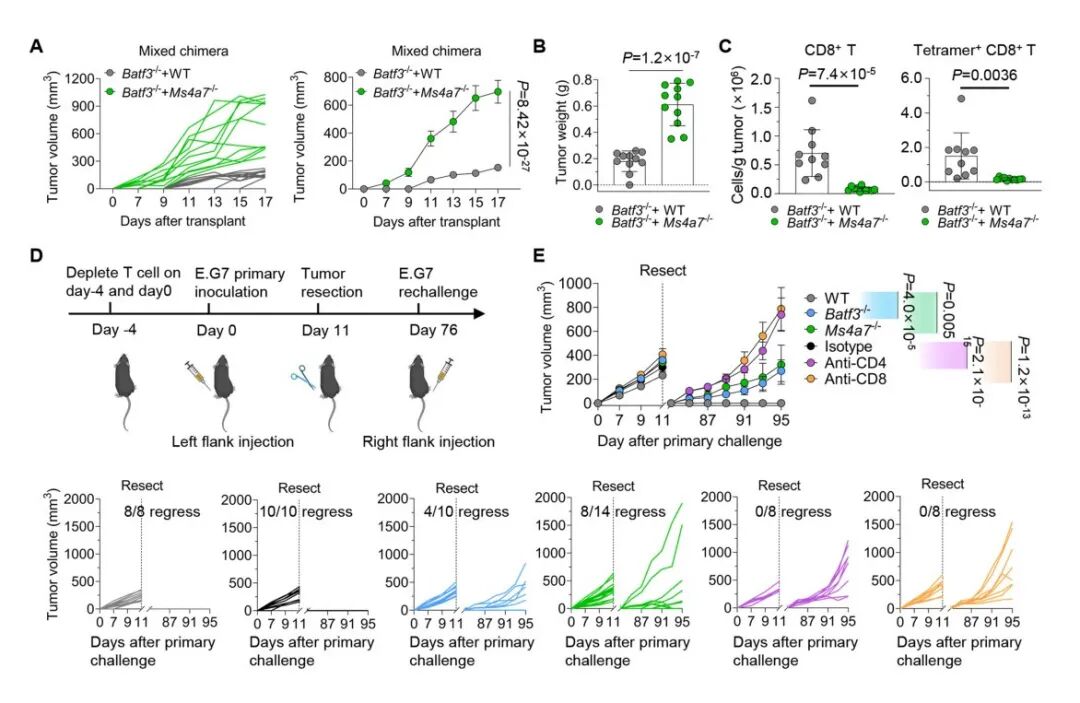
(A-C) 小鼠骨髓嵌合模型结果表明Ms4a7通过影响cDC1功能调控CD8+T细胞的抗肿瘤免疫反应 (D, E) Ms4a7缺失削弱记忆T细胞相关的抗肿瘤免疫反应。
成瘤实验:间接影响免疫因子释放
那么,Ms4a7基因到底是如何帮助“王牌情报员”cDC1细胞工作的呢?研究团队继续通过实验探索。
他们发现,不管有没有Ms4a7基因,都不影响 cDC1细胞从祖细胞分化为合格的抗原递呈细胞,cDC1细胞照样能顺利摄取肿瘤抗原、降解为短肽,但这里存在一个关键变化:在Ms4a7基因缺失的肿瘤微环境中,cDC1细胞分泌的关键免疫因子IL12、IL18、IL27变少了。
这三种免疫因子是“动员令”,能增强CD8 T细胞的作战能力。补充这些因子后,cDC1细胞激活T细胞的能力可部分恢复。更有趣的是,Ms4a7基因并不直接调控这些因子的释放,而是通过影响cDC1细胞功能状态,改变肿瘤微环境,引发“牵一发而动全身”的连锁反应 ——cDC1细胞功能减弱→T细胞激活不足→肿瘤生长加速→抑制信号增多→免疫因子分泌进一步减少。
从小鼠走向人类
基础医学研究的最终意义,在于能否应用于人类。此前的实验都在小鼠模型中进行,在证实Ms4a7基因的作用后,研究团队立刻将目光投向了人类肿瘤组织。
小鼠中,Ms4a7基因可以调控cDC1细胞,那么人体内是否也同样存在这个基因表达呢?答案是肯定的。
在分析膀胱尿路上皮癌和宫颈鳞状细胞癌的单细胞测序数据后,研究团队发现在人类cDC1细胞中,也有一部分表达MS4A7基因,而且表达这个基因的cDC1细胞,抗原递呈能力更活跃。通过多重免疫组化实验,他们在临床肿瘤样本中也看到了同样的现象。
更令人振奋的是,临床数据显示,肿瘤组织中表达MS4A7基因cDC1细胞的患者,复发率更低,生存时间更长,这说明,这群细胞可能是连接抗肿瘤免疫的重要枢纽之一。
在整合了TCGA数据库中多种人类肿瘤数据之后,结果也如他们所料,MS4A7基因的表达水平、cDC1细胞以及CD8T细胞的数量,三者相互依赖,共同构成了预测肿瘤患者免疫应答与临床结局的关键维度。

(A) 通过多色免疫组化检测人源膀胱尿路上皮癌和宫颈鳞状细胞癌组织及引流淋巴结中cDC1与CD8+T细胞的空间互作。(B-E) 通过统计分析比较各类组织中MS4A7+或MS4A7-cDC1细胞与CD8+T细胞形成cluster的密度差异。
2020年,当时还是清华大学博士后的谢波文开始投身这项研究,到今年11月论文上线,研究历时近六年。从构建模型、筛选基因,到抽丝剥茧、层层探索、临床验证,研究的难度远远超过了研究人员当初的想象,这个“王牌情报员”在人体外周血中的比例只有百分之零点几,每一步实验都需要极大的耐心和精准的操作。
这项研究为理解树突状细胞功能调控机制提供了新的视角,还为肿瘤免疫治疗提供了全新的靶点和生物标志物。未来,科学家们或许可以通过激活Ms4a7分子或者更多功能类似分子的表达,强化cDC1细胞的“情报传递”能力,让免疫系统更精准地打击肿瘤。
即便置身于高度抑制性的肿瘤微环境中,cDC1细胞依旧能坚守职责,为免疫系统提供有力支援。我们也有理由相信,在对抗癌症的漫长征程中,每一项基础研究的突破,都是在黑暗中点亮了一盏灯火。
或许基础研究不能在此刻立即发挥作用,但是治疗疾病的方法正是在一点一点看清真相的过程中,慢慢变成现实。
西湖大学董晨教授为本研究通讯作者,助理研究员谢波文为第一作者。中南大学湘雅三医院和上海芯超生物提供临床样本,清华大学祁海课题组、董忠军课题组和吴励课题组提供了课题相关小鼠品系。本研究得到国家重点研发计划、国家自然科学基金、中国医学科学院创新单元项目以及中国博士后基金的支持。
实验室简介
董晨,中国科学院院士,美国免疫学家协会杰出会士,现任西湖大学峰颖讲席教授,西湖大学副校长兼医学院院长,西湖大学医学院附属杭州市第一人民医院院长。曾获得2009年美国免疫家学会BD Bioscience研究者奖、2019年国际细胞因子与干扰素协会Biolegend-William E. Paul Award奖等。
董晨实验室主要致力于T细胞相关免疫耐受和免疫应答的分子调控机制,以及自身免疫性疾病、炎症和肿瘤中的新型肿瘤免疫治疗方法。在T细胞分化和自身免疫疾病领域做出了多项开创性贡献,其研究对于治疗免疫性疾病带来了深远的影响, 也给肿瘤免疫治疗提供新的思路。

















