
医学院 新闻动态
2025年11月18日,西湖大学医学院董晨团队在Nature Immunology杂志发表题为Analysis of the three-dimensional genome of exhausted CD8⁺ T cells reveals a critical role of IRF8 in their differentiation and functions in cancer的研究论文。该研究构建了肿瘤特异性耗竭CD8⁺ T细胞的染色质空间结构图谱,揭示了转录因子IRF8通过招募结构蛋白CTCF重塑染色质空间结构、调节基因表达,进而调控耗竭CD8⁺ T细胞分化及抗肿瘤功能,为理解肿瘤耗竭CD8⁺ T分化机制提供了新的视角,并为开发针对肿瘤的新型免疫治疗策略提供了潜在的靶点。
原文链接:
https://www.nature.com/articles/s41590-025-02330-4

01研究背景
CD8⁺ T细胞是机体抗肿瘤与抗病毒免疫反应的核心效应细胞。在肿瘤微环境或慢性感染中,长期的抗原刺激会使其逐渐进入耗竭状态,表现为高表达抑制性受体、效应功能减弱、增殖能力下降以及对免疫检查点抑制剂的响应不佳。既往研究已描绘了肿瘤耗竭CD8⁺ T细胞分化过程中转录组和多维表观基因组学的变化,但高级染色质空间结构在耗竭CD8⁺ T细胞分化过程中的变化及其对基因表达与功能的调控仍不清楚。董晨团队此前在Nature Communications发表研究,揭示了TRIM28调控染色质三维结构促进CD8⁺ T细胞活化。此次研究进一步聚焦肿瘤耗竭CD8⁺ T细胞分化过程中的染色质空间构象重塑,从三维基因组层面探究肿瘤耗竭CD8⁺ T细胞分化的分子机制。
02主要科研成果
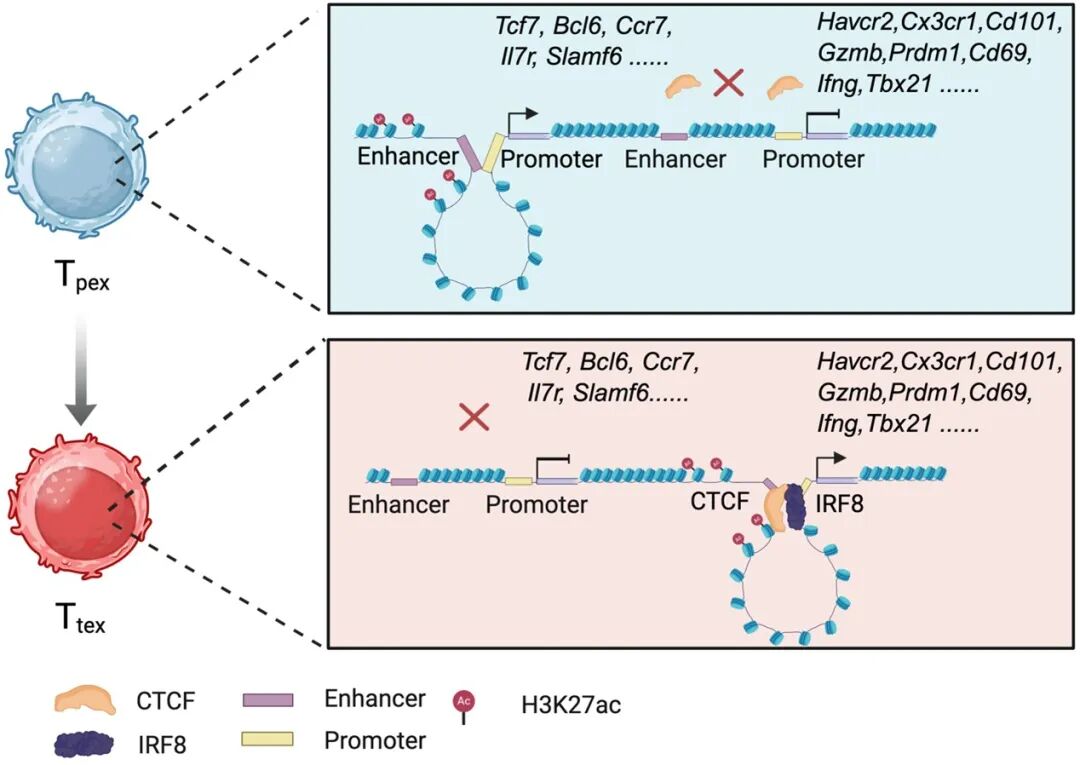
在本项研究中,董晨团队在肿瘤和病毒感染模型中,利用 Hi-C 技术对 CD8⁺ T细胞从幼稚、效应、记忆到耗竭阶段进行了系统解析,构建了高分辨率三维基因组图谱,揭示 CD8⁺ T细胞分化过程中伴随着广泛的染色质空间结构重塑。在耗竭型“祖细胞”亚群(Tpex)向终末分化的耗竭型CD8+ T细胞(Ttex)分化过程中,其染色质三维结构经历了显著的重塑,其中染色质环中有45%的结构发生了重组。这些变化与基因的转录调控密切相关,对耗竭CD8⁺ T细胞的分化和效应功能至关重要。
进一步的研究发现,转录因子IRF8在这一过程中发挥着核心作用。IRF8缺失显著抑制肿瘤耗竭CD8⁺ T细胞的分化,具体表现为 IRF8的缺失导致肿瘤特异性的Ttex细胞比例显著下降,而Tpex细胞比例增加。这说明IRF8对于肿瘤耗竭CD8⁺ T细胞的分化具有重要的调控作用。同时,IRF8缺失导致耗竭CD8⁺ T细胞干扰素γ和颗粒酶B等效应细胞因子的分泌能力显著降低,损害了耗竭CD8⁺ T细胞的抗肿瘤能力。机制方面,IRF8缺失显著影响肿瘤耗竭CD8⁺ T细胞的染色质三维结构重组。进一步实验结果证明,IRF8招募CTCF促进染色质环结构的形成,从而调控T细胞耗竭相关的基因表达。
03研究意义
该研究首次构建了肿瘤相关的耗竭CD8⁺ T细胞的染色质结构图谱,揭示了 IRF8在肿瘤耗竭CD8⁺ T细胞分化中的关键作用,还为开发针对肿瘤的新型免疫治疗策略提供了潜在的靶点。通过调节IRF8的功能,有望增强CD8⁺ T细胞的活性,从而提高机体对肿瘤的免疫应答能力。
西湖大学医学院的董晨教授是这一研究的通讯作者,清华大学免疫所博士后李瑞风,已毕业博士生危琨为共同第一作者。清华大学免疫所曾文文教授提供了重要帮助。本研究得到了国家自然科学基金、国家重点研发项目和新基石基金的大力资助。
最新资讯
新闻动态
新闻动态

















