
医学院 新闻动态
细胞疗法是现代医学的重要前沿,但如何实现即时、可控的蛋白质分泌,仍是这一领域的关键挑战之一。当前大多数细胞疗法依赖于基因转录水平的调控,响应速度较慢,难以满足即时治疗的需求,尤其是需要即时调节治疗蛋白分泌的疾病,如I型糖尿病中的胰岛素。虽然已有一些基于光、电或温度的控制方法,但在临床应用上仍存在可行性和安全性限制。因此,开发一种既能快速响应,又能使用安全、可调控信号的蛋白分泌系统,成为解决这一难题的关键。

2025年3月22日,来自西湖大学医学院解明岐团队在Nature Communications发表了题为On-demand treatment of metabolic diseases by a synthetic drug-inducible exocytosis system的研究论文。研究团队通过重构钙信号通路,设计出“双组件分子开关”——将钙通道激活模块拆分为“信号接收器”与“触发器”(StimExo),利用小分子药物(如FDA已批准的抗病毒药物Grazoprevir)诱导二者结合,瞬时可控制细胞的钙离子流入,触发胞内预存治疗蛋白的瞬时释放。在糖尿病小鼠模型中,研究团队通过植入StimExo改造的胰岛前体细胞,实现通过Grazoprevir给药对血糖水平进行实时控制。这一系统的开发为细胞疗法提供了一种更高效、安全且可广泛适用的新策略。
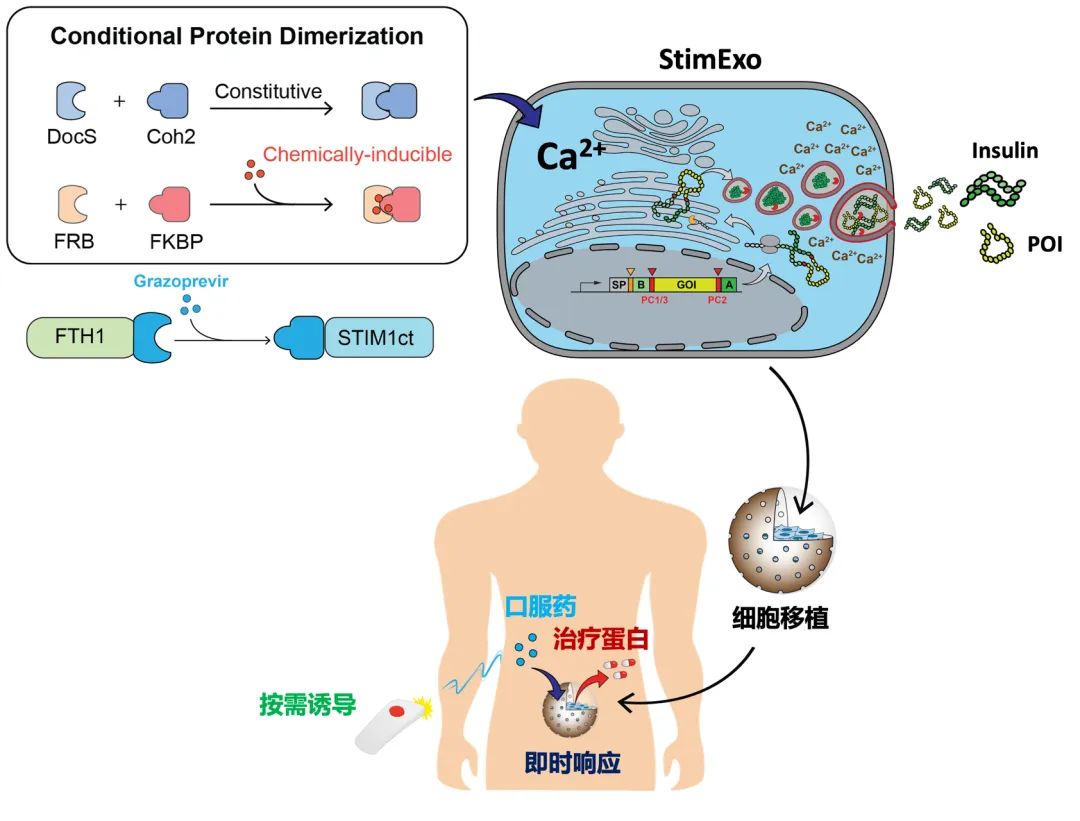
1. 设计并验证了可被多种信号诱导的钙离子调控元件
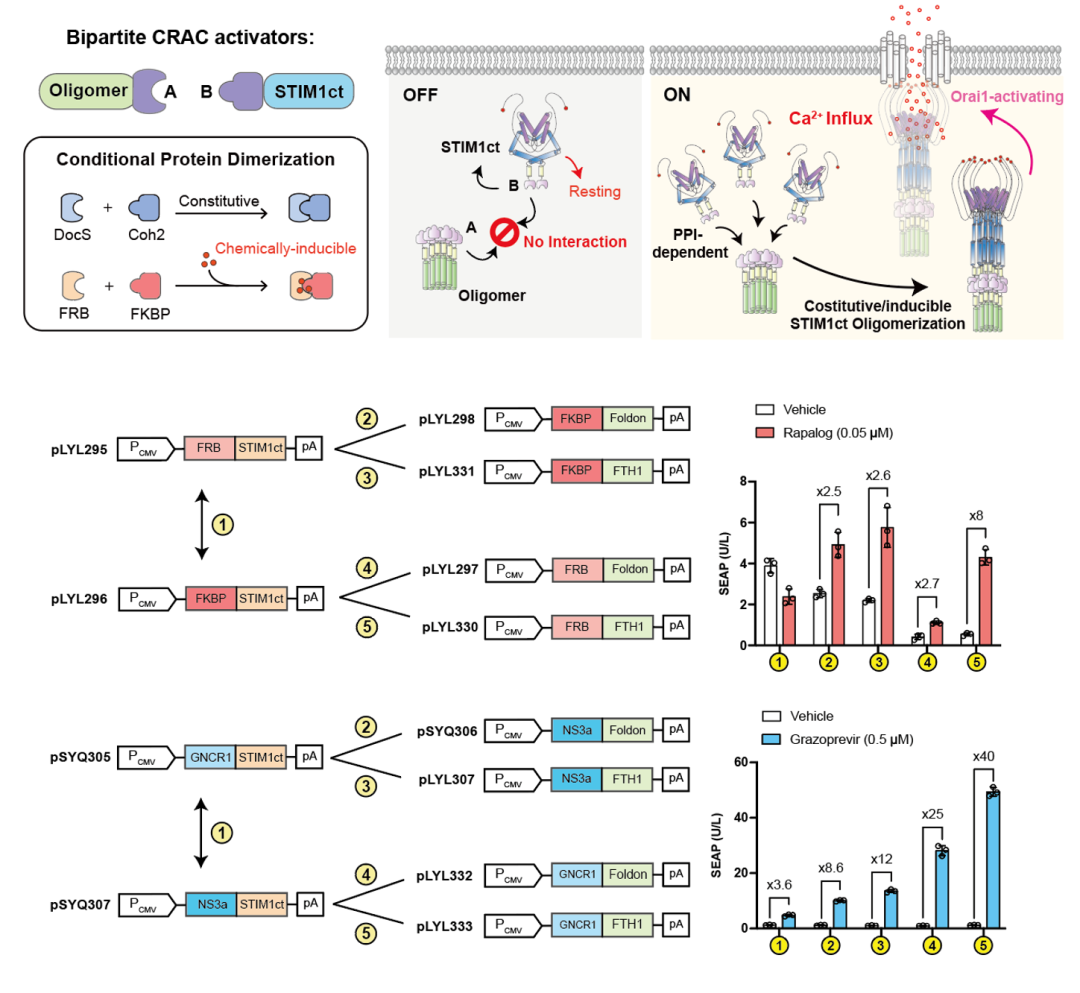
我们用模块化组装方式开发了两组分的CRAC激活元件,其中STIM1蛋白的STIM1ct和寡聚体结构域被拆分成两个独立的蛋白,这两种蛋白可以通过不同的蛋白质相互作用组合(PPI)有条件进行重组。通过这种方式,寡聚蛋白复合物和含STIM1ct构建体的表达在设计上是相互独立的,直到特定PPI的存在决定了单体STIM1ct分子是否应加入预先形成的寡聚“对接站”进行STIM1ct聚集、膜转位和Orai1激活等这一系列生物过程。研究证实,在可诱导蛋白互作的小分子Rapalog和Grazoprevir作用下,两种两组分CRAC激活元件都可成功诱导Orai1钙离子通道的激活并引起钙离子内流。
2. Grazoprevir诱导的Ca2+内流可以促进内分泌细胞内源性激素的释放
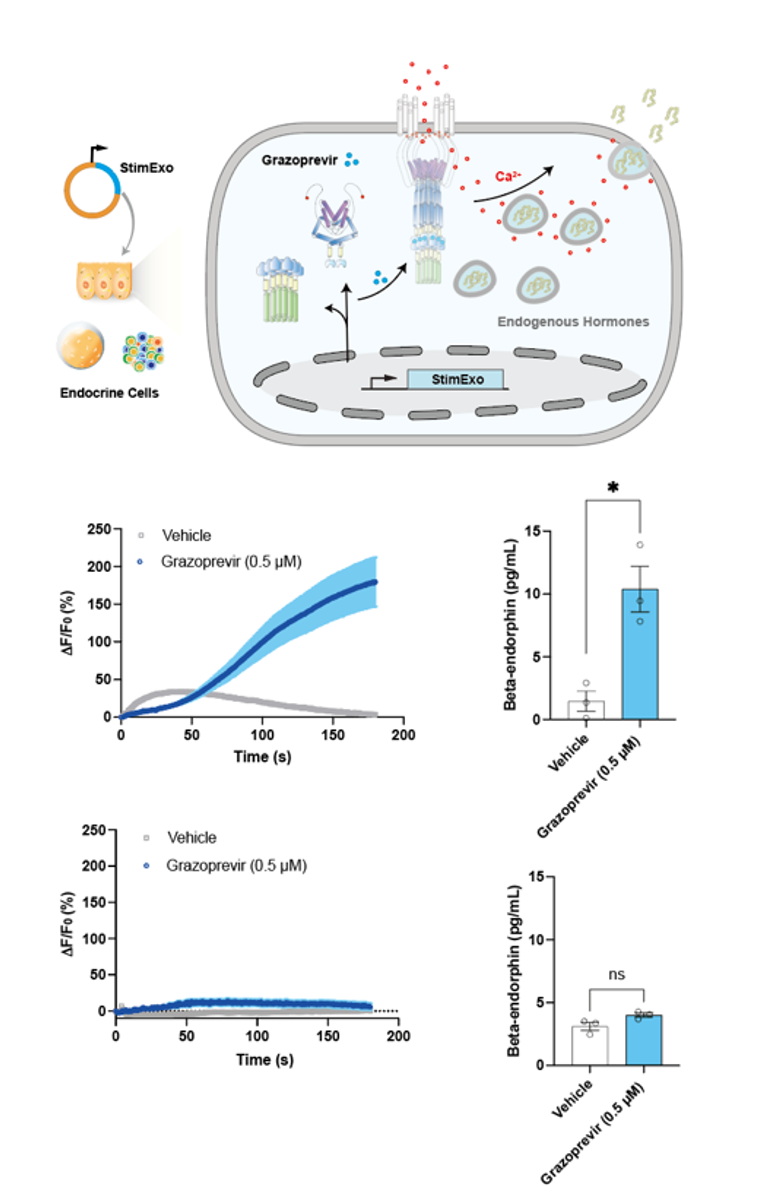
接下来,我们试图在Grazoprevir诱导的CRAC激活元件和蛋白质胞吐之间建立联系来合成可控的胞吐分泌系统。在人体中,许多具有治疗价值的肽激素储存在内分泌细胞的分泌颗粒内,这些分泌囊泡在细胞内Ca2+激增后迅速释放其内容物。为了测试grazoprevir调节的CRAC激活是否可以触发内源性激素释放,我们将此CRAC钙离子调控元件‘StimExo’的基因组分(NS3a-STIM1ct和GNCR1-FTH1)瞬时转染到B16-F10细胞中,实验结果表明在Grazoprevir刺激下,StimExo可引起B16-F10中钙离子内流并释放内啡肽,而没有表达StimExo的B16-F10则不能。
3. 按需分泌各种目的治疗蛋白的药物诱导胞吐系统的开发
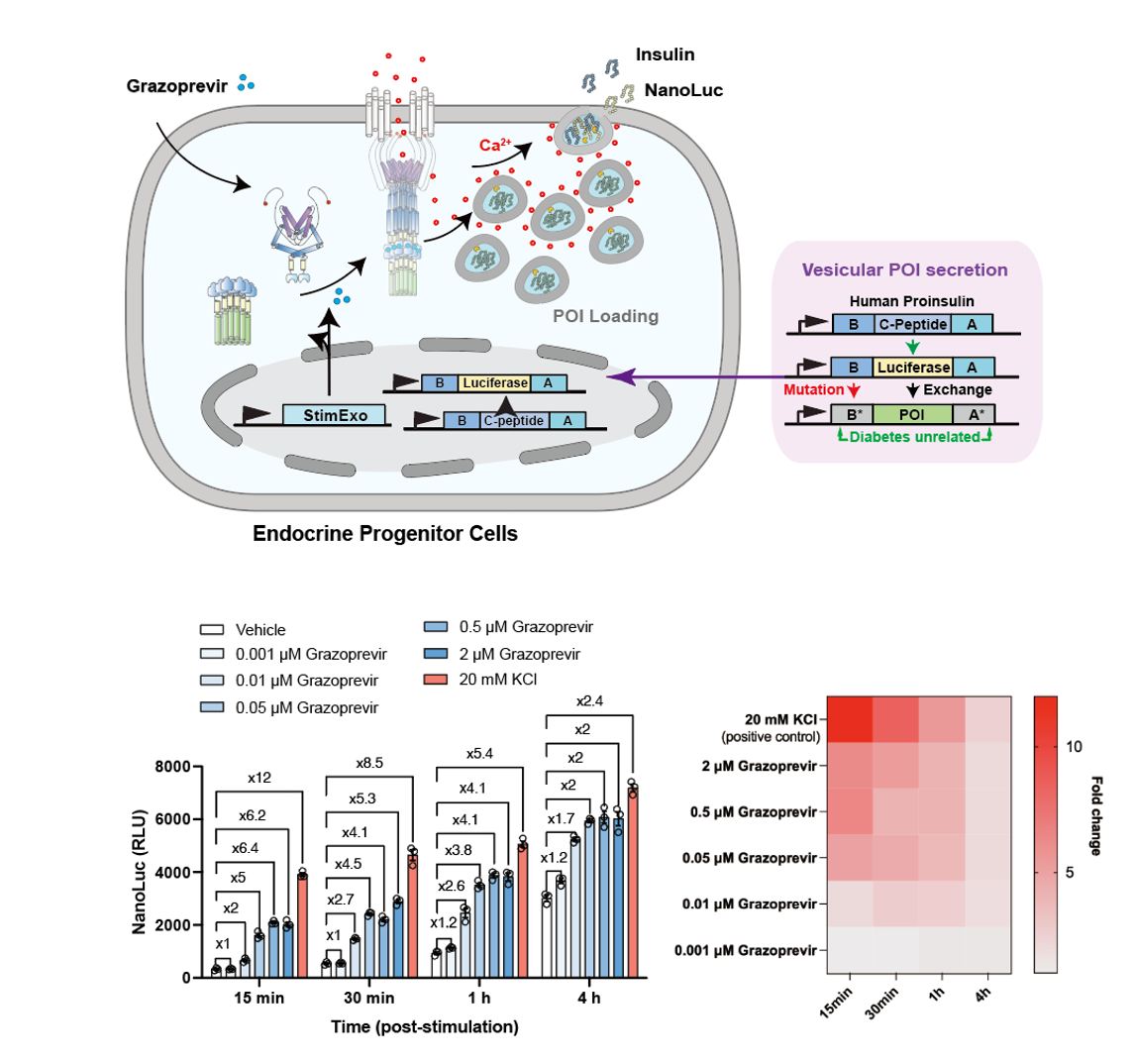
为了搭载各种目的蛋白进入胞吐囊泡,我们引入胰岛素原骨架用作各种内分泌细胞类型中的通用表达系统。胰岛素原的C肽部分可以被交换成编码任何其他POI的任意基因序列,从而通过利用胰岛素的天然胞吐机制允许囊泡POI分泌,我们的研究证实将StimExo系统与胰岛素原骨架整合,可在胰岛前体细胞中实现Grazoprevir对POI的诱导胞吐。我们将这种整合后的细胞疗法称为“StimExoINS”。
4. 通过Grazoprevir诱导胞吐的细胞疗法实现血糖稳态的实时调控
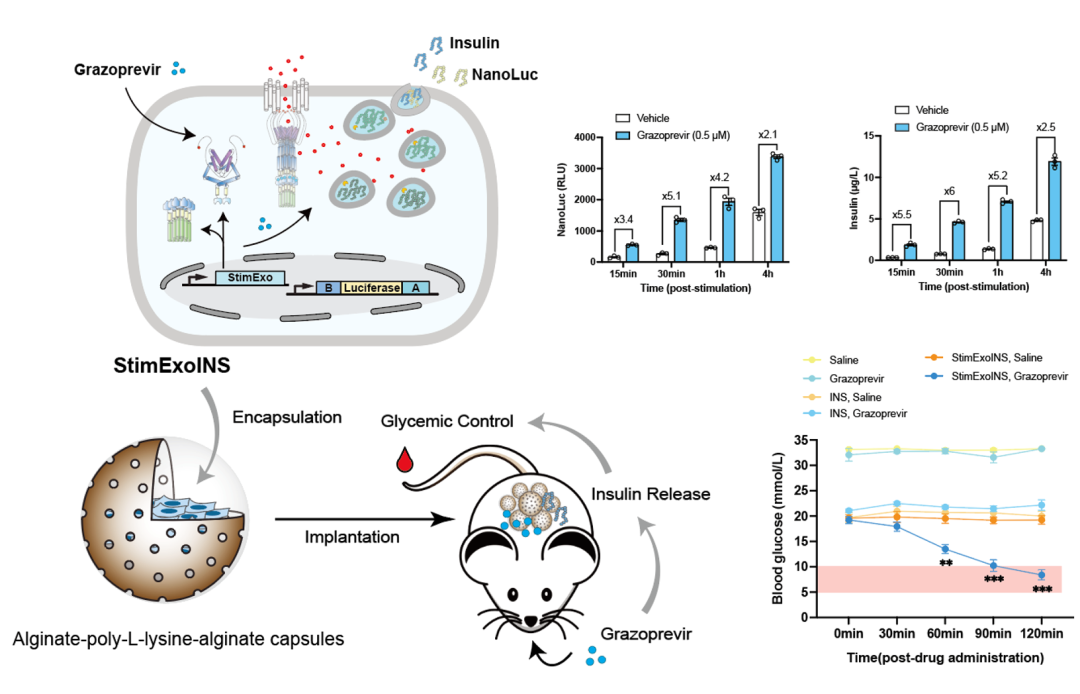
为了验证“StimExoINS”在体内的快速治疗效果,我们将微胶囊包裹的StimExoINS细胞移植入1型糖尿病小鼠体内,研究发现移植StimExoINS的小鼠,在Grazoprevir给药1h内可以看到显著的血糖降低,2h时基本到达正常血糖值。而Grazoprevir药物或底盘ElectroBeta细胞自身都无法调节血糖。因此,StimExoINS可以有效地实现治疗蛋白的快速释放,未来有希望应用于急需即时药物作用的代谢性疾病的治疗。
结语

















